当前位置:
X-MOL 学术
›
J. Cell. Biochem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
单个氨基酸取代对TANK结合激酶1结构和功能的影响
Journal of Cellular Biochemistry ( IF 3.0 ) Pub Date : 2021-07-08 , DOI: 10.1002/jcb.30070 Mohd Umair 1 , Shama Khan 2 , Taj Mohammad 3 , Alaa Shafie 4 , Farah Anjum 4 , Asimul Islam 3 , Md Imtaiyaz Hassan 3
Journal of Cellular Biochemistry ( IF 3.0 ) Pub Date : 2021-07-08 , DOI: 10.1002/jcb.30070 Mohd Umair 1 , Shama Khan 2 , Taj Mohammad 3 , Alaa Shafie 4 , Farah Anjum 4 , Asimul Islam 3 , Md Imtaiyaz Hassan 3
Affiliation
|
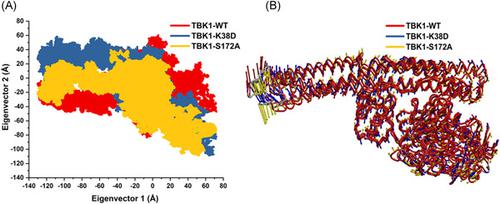
坦克结合激酶 1 (TBK1) 是一种丝氨酸/苏氨酸蛋白激酶,参与各种信号通路,随后调节细胞增殖、凋亡、自噬、抗病毒和抗肿瘤免疫。TBK1的功能障碍可导致许多复杂的疾病,包括自身免疫、神经退行性变和癌症。TBK1 的这种功能障碍可能是由单个氨基酸取代和随后的结构改变引起的。本研究使用先进的计算方法和各种工具分析了取代氨基酸对 TBK1 结构、功能和后续疾病的影响。在初步评估中,共有 467 个突变被发现是有害的。之后,在详细的结构和顺序分析中,发现 13 个突变是致病的。最后,根据功能重要性,通过利用 200 ns 的全原子分子动力学 (MD) 模拟,选择并详细研究了 TBK1 激酶结构域的两个变体(K38D 和 S172A)。MD 模拟,包括相关矩阵和主成分分析,有助于在原子水平上更深入地了解 TBK1 结构。我们观察到变体构象发生了实质性变化,这可能导致结构改变和随后的 TBK1 功能障碍。然而,与 K38D 相比,替代 S172A 在 TBK1 结构中显示出显着的构象变化。因此,本研究为了解突变对 TBK1 激酶结构域的影响及其与疾病进展相关的功能提供了结构基础。MD 模拟,包括相关矩阵和主成分分析,有助于在原子水平上更深入地了解 TBK1 结构。我们观察到变体构象发生了实质性变化,这可能导致结构改变和随后的 TBK1 功能障碍。然而,与 K38D 相比,替代 S172A 在 TBK1 结构中显示出显着的构象变化。因此,本研究为了解突变对 TBK1 激酶结构域的影响及其与疾病进展相关的功能提供了结构基础。MD 模拟,包括相关矩阵和主成分分析,有助于在原子水平上更深入地了解 TBK1 结构。我们观察到变体构象发生了实质性变化,这可能导致结构改变和随后的 TBK1 功能障碍。然而,与 K38D 相比,替代 S172A 在 TBK1 结构中显示出显着的构象变化。因此,本研究为了解突变对 TBK1 激酶结构域的影响及其与疾病进展相关的功能提供了结构基础。这可能导致结构改变和随后的 TBK1 功能障碍。然而,与 K38D 相比,替代 S172A 在 TBK1 结构中显示出显着的构象变化。因此,本研究为了解突变对 TBK1 激酶结构域的影响及其与疾病进展相关的功能提供了结构基础。这可能导致结构改变和随后的 TBK1 功能障碍。然而,与 K38D 相比,替代 S172A 在 TBK1 结构中显示出显着的构象变化。因此,本研究为了解突变对 TBK1 激酶结构域的影响及其与疾病进展相关的功能提供了结构基础。

"点击查看英文标题和摘要"
更新日期:2021-07-08

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号