当前位置:
X-MOL 学术
›
ACS Catal.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
FUT8-Directed Core Fucosylation of N-glycans Is Regulated by the Glycan Structure and Protein Environment
ACS Catalysis ( IF 11.3 ) Pub Date : 2021-07-08 , DOI: 10.1021/acscatal.1c01698 Ana García-García 1 , Sonia Serna 2 , Zhang Yang 3 , Ignacio Delso 4 , Víctor Taleb 1 , Thomas Hicks 4 , Raik Artschwager 2 , Sergey Y Vakhrushev 3 , Henrik Clausen 3 , Jesús Angulo 4, 5, 6 , Francisco Corzana 7 , Niels C Reichardt 2, 8 , Ramon Hurtado-Guerrero 1, 3, 9
ACS Catalysis ( IF 11.3 ) Pub Date : 2021-07-08 , DOI: 10.1021/acscatal.1c01698 Ana García-García 1 , Sonia Serna 2 , Zhang Yang 3 , Ignacio Delso 4 , Víctor Taleb 1 , Thomas Hicks 4 , Raik Artschwager 2 , Sergey Y Vakhrushev 3 , Henrik Clausen 3 , Jesús Angulo 4, 5, 6 , Francisco Corzana 7 , Niels C Reichardt 2, 8 , Ramon Hurtado-Guerrero 1, 3, 9
Affiliation
|
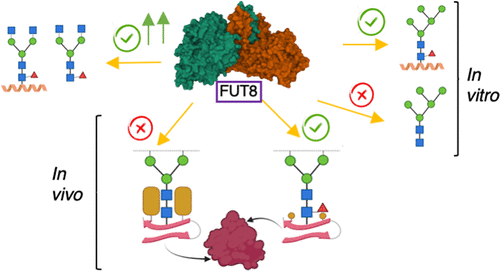
FUT8 is an essential α-1,6-fucosyltransferase that fucosylates the innermost GlcNAc of N-glycans, a process called core fucosylation. In vitro, FUT8 exhibits substrate preference for the biantennary complex N-glycan oligosaccharide (G0), but the role of the underlying protein/peptide to which N-glycans are attached remains unclear. Here, we explored the FUT8 enzyme with a series of N-glycan oligosaccharides, N-glycopeptides, and an Asn-linked oligosaccharide. We found that the underlying peptide plays a role in fucosylation of paucimannose (low mannose) and high-mannose N-glycans but not for complex-type N-glycans. Using saturation transfer difference (STD) NMR spectroscopy, we demonstrate that FUT8 recognizes all sugar units of the G0 N-glycan and most of the amino acid residues (Asn-X-Thr) that serve as a recognition sequon for the oligosaccharyltransferase (OST). The largest STD signals were observed in the presence of GDP, suggesting that prior FUT8 binding to GDP-β-l-fucose (GDP-Fuc) is required for an optimal recognition of N-glycans. We applied genetic engineering of glycosylation capacities in CHO cells to evaluate FUT8 core fucosylation of high-mannose and complex-type N-glycans in cells with a panel of well-characterized therapeutic N-glycoproteins. This confirmed that core fucosylation mainly occurs on complex-type N-glycans, although clearly only at selected glycosites. Eliminating the capacity for complex-type glycosylation in cells (KO mgat1) revealed that glycosites with complex-type N-glycans when converted to high mannose lost the core Fuc. Interestingly, however, for erythropoietin that is uncommon among the tested glycoproteins in efficiently acquiring tetra-antennary N-glycans, two out of three N-glycosites obtained Fuc on the high-mannose N-glycans. An examination of the N-glycosylation sites of several protein crystal structures indicates that core fucosylation is mostly affected by the accessibility and nature of the N-glycan and not by the nature of the underlying peptide sequence. These data have further elucidated the different FUT8 acceptor substrate specificities both in vitro and in vivo in cells, revealing different mechanisms for promoting core fucosylation.
中文翻译:

N-聚糖的 FUT8 定向核心岩藻糖基化受聚糖结构和蛋白质环境的调节
FUT8 是一种必需的 α-1,6-岩藻糖基转移酶,可将 N-聚糖最内层的 GlcNAc 进行岩藻糖基化,这一过程称为核心岩藻糖基化。体外, FUT8 表现出对双触角复合物 N-聚糖寡糖 (G0) 的底物偏好,但与 N-聚糖连接的潜在蛋白质/肽的作用仍不清楚。在这里,我们用一系列 N-聚糖寡糖、N-糖肽和 Asn 连接的寡糖探索了 FUT8 酶。我们发现潜在肽在少甘露糖(低甘露糖)和高甘露糖 N-聚糖的岩藻糖基化中起作用,但对复杂型 N-聚糖不起作用。使用饱和转移差 (STD) NMR 光谱,我们证明 FUT8 识别 G0 N-聚糖的所有糖单元和作为寡糖基转移酶 (OST) 识别序列的大部分氨基酸残基 (Asn-X-Thr) . 在存在 GDP 的情况下观察到最大的 STD 信号,表明先前的 FUT8 与 GDP-β-结合l -岩藻糖 (GDP-Fuc) 是最佳识别 N-聚糖所必需的。我们在 CHO 细胞中应用糖基化能力的基因工程来评估细胞中高甘露糖和复合型 N-聚糖的 FUT8 核心岩藻糖基化,以及一组经过充分表征的治疗性 N-糖蛋白。这证实了核心岩藻糖基化主要发生在复合型 N-聚糖上,尽管显然只发生在选定的糖位点上。消除细胞中复杂型糖基化的能力(KO mgat1) 揭示了具有复杂型 N-聚糖的糖位点在转化为高甘露糖时失去了核心 Fuc。然而,有趣的是,对于在有效获得四触角 N-聚糖的测试糖蛋白中不常见的促红细胞生成素,三个 N-糖苷中的两个在高甘露糖 N-聚糖上获得了 Fuc。对几种蛋白质晶体结构的 N-糖基化位点的检查表明,核心岩藻糖基化主要受 N-聚糖的可及性和性质的影响,而不是受潜在肽序列性质的影响。这些数据进一步阐明了细胞体外和体内不同的 FUT8 受体底物特异性,揭示了促进核心岩藻糖基化的不同机制。
更新日期:2021-08-07
中文翻译:

N-聚糖的 FUT8 定向核心岩藻糖基化受聚糖结构和蛋白质环境的调节
FUT8 是一种必需的 α-1,6-岩藻糖基转移酶,可将 N-聚糖最内层的 GlcNAc 进行岩藻糖基化,这一过程称为核心岩藻糖基化。体外, FUT8 表现出对双触角复合物 N-聚糖寡糖 (G0) 的底物偏好,但与 N-聚糖连接的潜在蛋白质/肽的作用仍不清楚。在这里,我们用一系列 N-聚糖寡糖、N-糖肽和 Asn 连接的寡糖探索了 FUT8 酶。我们发现潜在肽在少甘露糖(低甘露糖)和高甘露糖 N-聚糖的岩藻糖基化中起作用,但对复杂型 N-聚糖不起作用。使用饱和转移差 (STD) NMR 光谱,我们证明 FUT8 识别 G0 N-聚糖的所有糖单元和作为寡糖基转移酶 (OST) 识别序列的大部分氨基酸残基 (Asn-X-Thr) . 在存在 GDP 的情况下观察到最大的 STD 信号,表明先前的 FUT8 与 GDP-β-结合l -岩藻糖 (GDP-Fuc) 是最佳识别 N-聚糖所必需的。我们在 CHO 细胞中应用糖基化能力的基因工程来评估细胞中高甘露糖和复合型 N-聚糖的 FUT8 核心岩藻糖基化,以及一组经过充分表征的治疗性 N-糖蛋白。这证实了核心岩藻糖基化主要发生在复合型 N-聚糖上,尽管显然只发生在选定的糖位点上。消除细胞中复杂型糖基化的能力(KO mgat1) 揭示了具有复杂型 N-聚糖的糖位点在转化为高甘露糖时失去了核心 Fuc。然而,有趣的是,对于在有效获得四触角 N-聚糖的测试糖蛋白中不常见的促红细胞生成素,三个 N-糖苷中的两个在高甘露糖 N-聚糖上获得了 Fuc。对几种蛋白质晶体结构的 N-糖基化位点的检查表明,核心岩藻糖基化主要受 N-聚糖的可及性和性质的影响,而不是受潜在肽序列性质的影响。这些数据进一步阐明了细胞体外和体内不同的 FUT8 受体底物特异性,揭示了促进核心岩藻糖基化的不同机制。

































 京公网安备 11010802027423号
京公网安备 11010802027423号