当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
细胞色素 P450 3A4 在底物和细胞色素 P450 还原酶存在下的结构动力学
Biochemistry ( IF 2.9 ) Pub Date : 2021-07-01 , DOI: 10.1021/acs.biochem.1c00178
Julie Ducharme 1 , Irina F Sevrioukova 2 , Christopher J Thibodeaux 1 , Karine Auclair 1
Biochemistry ( IF 2.9 ) Pub Date : 2021-07-01 , DOI: 10.1021/acs.biochem.1c00178
Julie Ducharme 1 , Irina F Sevrioukova 2 , Christopher J Thibodeaux 1 , Karine Auclair 1
Affiliation
|
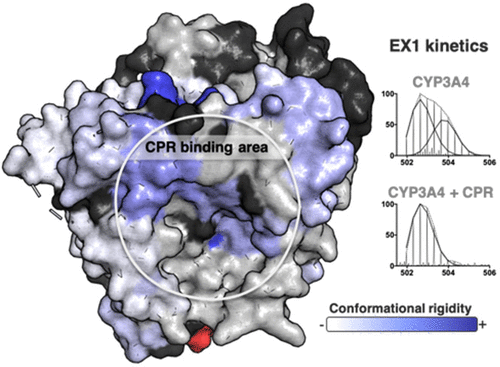
细胞色素 P450 3A4 (CYP3A4) 是人类最重要的药物代谢酶,与有害的药物相互作用有关。已知 CYP3A4 的活性受几种化合物和电子转移伴侣细胞色素 P450 还原酶 (CPR) 的调节。然而,人们对这些影响的潜在机制知之甚少。我们使用氢-氘交换质谱来研究 CPR 和三种不同底物(7-苄氧基-4-三氟甲基-香豆素、睾酮和孕酮)的结合对 CYP3A4 构象动力学的影响。在这里,我们报告 CYP3A4 与底物或与 CPR 的氧化或还原形式的相互作用导致 CYP3A4 结构的整体僵化。这从 CYP3A4 的几个区域的氘交换抑制中可以看出,包括已知参与蛋白质-蛋白质相互作用(螺旋 C)和底物结合和特异性(螺旋 B' 和 E,以及环 K/β1)的区域。此外,观察到的一些 CYP3A4 衍生肽的双峰同位素分布在与 CPR 和/或底物结合时受到极大影响,表明存在受配体/CPR 结合干扰的稳定 CYP3A4 构象群。该结果对理解 CYP 酶中配体结合、变构和催化的机制具有重要意义。表明存在受配体/CPR结合干扰的稳定CYP3A4构象群。该结果对理解 CYP 酶中配体结合、变构和催化的机制具有重要意义。表明存在受配体/CPR结合干扰的稳定CYP3A4构象群。该结果对理解 CYP 酶中配体结合、变构和催化的机制具有重要意义。

"点击查看英文标题和摘要"
更新日期:2021-07-20

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号