当前位置:
X-MOL 学术
›
J. Phys. Chem. B
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Combining Rapid Microfluidic Mixing and Three-Color Single-Molecule FRET for Probing the Kinetics of Protein Conformational Changes
The Journal of Physical Chemistry B ( IF 2.8 ) Pub Date : 2021-06-14 , DOI: 10.1021/acs.jpcb.1c02370 Stephan Benke 1 , Andrea Holla 1 , Bengt Wunderlich 1 , Andrea Soranno 1, 2 , Daniel Nettels 1 , Benjamin Schuler 1, 3
The Journal of Physical Chemistry B ( IF 2.8 ) Pub Date : 2021-06-14 , DOI: 10.1021/acs.jpcb.1c02370 Stephan Benke 1 , Andrea Holla 1 , Bengt Wunderlich 1 , Andrea Soranno 1, 2 , Daniel Nettels 1 , Benjamin Schuler 1, 3
Affiliation
|
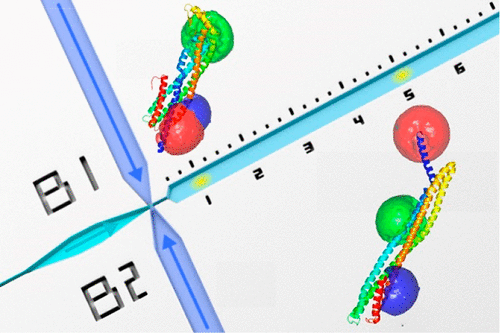
Single-molecule Förster resonance energy transfer (FRET) is well suited for studying the kinetics of protein conformational changes, owing to its high sensitivity and ability to resolve individual subpopulations in heterogeneous systems. However, the most common approach employing two fluorophores can only monitor one distance at a time, and the use of three fluorophores for simultaneously monitoring multiple distances has largely been limited to equilibrium fluctuations. Here we show that three-color single-molecule FRET can be combined with rapid microfluidic mixing to investigate conformational changes in a protein from milliseconds to minutes. In combination with manual mixing, we extended the kinetics to 1 h, corresponding to a total range of 5 orders of magnitude in time. We studied the monomer-to-protomer conversion of the pore-forming toxin cytolysin A (ClyA), one of the largest protein conformational transitions known. Site-specific labeling of ClyA with three fluorophores enabled us to follow the kinetics of three intramolecular distances at the same time and revealed a previously undetected intermediate. The combination of three-color single-molecule FRET with rapid microfluidic mixing thus provides an approach for probing the mechanisms of complex biomolecular processes with high time resolution.
中文翻译:

结合快速微流体混合和三色单分子 FRET 探索蛋白质构象变化的动力学
单分子 Förster 共振能量转移 (FRET) 非常适合研究蛋白质构象变化的动力学,因为它具有高灵敏度和解析异质系统中单个亚群的能力。然而,使用两个荧光团的最常见方法一次只能监测一个距离,而使用三个荧光团同时监测多个距离在很大程度上仅限于平衡波动。在这里,我们展示了三色单分子 FRET 可以与快速微流体混合相结合,以研究蛋白质从几毫秒到几分钟的构象变化。结合手动混合,我们将动力学扩展到 1 小时,对应于 5 个数量级的总时间范围。我们研究了成孔毒素溶细胞素 A (ClyA) 的单体到原体的转化,这是已知的最大的蛋白质构象转变之一。用三个荧光团对 ClyA 进行位点特异性标记使我们能够同时跟踪三个分子内距离的动力学,并揭示了以前未检测到的中间体。三色单分子 FRET 与快速微流体混合的结合因此提供了一种以高时间分辨率探测复杂生物分子过程机制的方法。
更新日期:2021-06-24
中文翻译:

结合快速微流体混合和三色单分子 FRET 探索蛋白质构象变化的动力学
单分子 Förster 共振能量转移 (FRET) 非常适合研究蛋白质构象变化的动力学,因为它具有高灵敏度和解析异质系统中单个亚群的能力。然而,使用两个荧光团的最常见方法一次只能监测一个距离,而使用三个荧光团同时监测多个距离在很大程度上仅限于平衡波动。在这里,我们展示了三色单分子 FRET 可以与快速微流体混合相结合,以研究蛋白质从几毫秒到几分钟的构象变化。结合手动混合,我们将动力学扩展到 1 小时,对应于 5 个数量级的总时间范围。我们研究了成孔毒素溶细胞素 A (ClyA) 的单体到原体的转化,这是已知的最大的蛋白质构象转变之一。用三个荧光团对 ClyA 进行位点特异性标记使我们能够同时跟踪三个分子内距离的动力学,并揭示了以前未检测到的中间体。三色单分子 FRET 与快速微流体混合的结合因此提供了一种以高时间分辨率探测复杂生物分子过程机制的方法。

































 京公网安备 11010802027423号
京公网安备 11010802027423号