Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
SUMOylation 和 PKCδ 磷酸化之间的相互作用促进氧化应激诱导的细胞凋亡
The FEBS Journal ( IF 5.5 ) Pub Date : 2021-06-05 , DOI: 10.1111/febs.16050 Siman Gao 1 , Xiangteng Zhao 1 , Lin Hou 1 , Ruining Ma 1 , Jie Zhou 1 , Michael X Zhu 2 , Si-Jian Pan 3 , Yong Li 1
The FEBS Journal ( IF 5.5 ) Pub Date : 2021-06-05 , DOI: 10.1111/febs.16050 Siman Gao 1 , Xiangteng Zhao 1 , Lin Hou 1 , Ruining Ma 1 , Jie Zhou 1 , Michael X Zhu 2 , Si-Jian Pan 3 , Yong Li 1
Affiliation
|
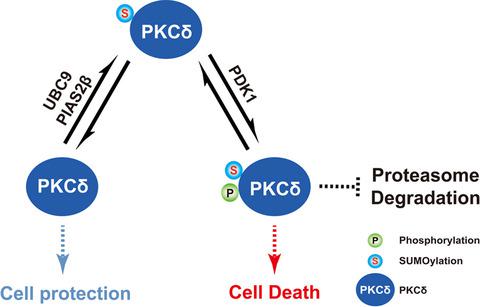
尽管已鉴定的翻译后修饰 (PTM) 数量的增加大大提高了我们对单个 PTM 的底物位点特异性的了解,但不同类型的 PTM 可以相互交流并协同作用以发挥重要的蛋白质功能调节机制这一事实尚未获得非常关注。在这里,我们显示蛋白激酶 Cδ (PKCδ) 在其 C 端催化域的 473 位赖氨酸处被 SUMO 化,并且 SUMO 化通过抑制其泛素化来增加 PKCδ 的稳定性。此外,我们发现了 PKCδ 磷酸化和 SUMOylation 之间的功能相互作用,这可以通过将 SUMO E2/E3 连接酶和 PKCδ 激酶分别招募到 PKCδ 复合物中来相互增强。我们将 PIAS2β 鉴定为 PKCδ 的 SUMO E3 连接酶。更重要的是,2 O 2。我们得出结论,SUMOylation 代表了 PKCδ PTM 对激酶在氧化细胞损伤中的功能的重要调节机制。

"点击查看英文标题和摘要"
更新日期:2021-06-05

"点击查看英文标题和摘要"


















































 京公网安备 11010802027423号
京公网安备 11010802027423号