当前位置:
X-MOL 学术
›
Environ. Sci. Technol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Comprehensive Understanding of Fluoroacetate Dehalogenase-Catalyzed Degradation of Fluorocarboxylic Acids: A QM/MM Approach
Environmental Science & Technology ( IF 10.8 ) Pub Date : 2021-06-03 , DOI: 10.1021/acs.est.0c08811
Yue Yue 1 , Jiaqian Fan 2 , Guoqing Xin 3 , Qun Huang 2 , Jian-Bo Wang 2 , Yanwei Li 1 , Qingzhu Zhang 1 , Wenxing Wang 1
Environmental Science & Technology ( IF 10.8 ) Pub Date : 2021-06-03 , DOI: 10.1021/acs.est.0c08811
Yue Yue 1 , Jiaqian Fan 2 , Guoqing Xin 3 , Qun Huang 2 , Jian-Bo Wang 2 , Yanwei Li 1 , Qingzhu Zhang 1 , Wenxing Wang 1
Affiliation
|
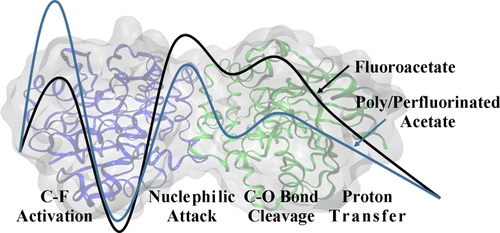
Fluorochemicals are persistent, bioaccumulative, and toxic compounds that are widely tributed in the environment. Developing efficient biodegradation strategies to decompose the fluorochemicals via breaking the inert C–F bonds presents a holistic challenge. As a promising biodegradation enzyme candidate, fluoroacetate dehalogenase (FAcD) has been reported as the only non-metallic enzyme to catalyze the cleavage of the strong C–F bond. Here, we systematically investigated the catalytic actions of FAcD toward its natural substrate fluoroacetate using molecular dynamics simulations and quantum mechanism/molecular mechanism calculations. We propose that the enzymatic transformation involves four elementary steps, (I) C–F bond activation, (II) nucleophilic attack, (III) C–O bond cleavage, and (IV) proton transfer. Our results show that nucleophilic attack is the rate-determining step. However, for difluoroacetate and trifluoroacetate, C–F bond activation, instead of nucleophilic attack, becomes the rate-determining step. We show that FAcD, originally recognized as α-fluorocarboxylic acid degradation enzyme, can catalyze the defluorination of difluoroacetate to glyoxylate, which is captured by our high-resolution mass spectrometry experiments. In addition, we employed amino acid electrostatic analysis method to screen potential mutation hotspots for tuning FAcD’s electrostatic environment to favor substrate conversion. The comprehensive understanding of catalytic mechanism will inform a rational enzyme engineering strategy to degrade fluorochemicals for benefits of environmental sustainability.
中文翻译:

全面了解氟乙酸脱卤酶催化的氟羧酸降解:QM/MM 方法
含氟化合物是在环境中广泛存在的持久性、生物累积性和有毒化合物。开发有效的生物降解策略以通过破坏惰性 C-F 键来分解含氟化合物是一项整体挑战。作为一种有前景的生物降解酶候选物,氟乙酸脱卤酶 (FAcD) 已被报道为唯一一种催化强 C-F 键断裂的非金属酶。在这里,我们使用分子动力学模拟和量子机制/分子机制计算系统地研究了 FAcD 对其天然底物氟乙酸酯的催化作用。我们建议酶促转化包括四个基本步骤,(I)C-F 键激活,(II)亲核攻击,(III)C-O 键断裂和(IV)质子转移。我们的结果表明亲核攻击是决定速率的步骤。然而,对于二氟乙酸酯和三氟乙酸酯,C-F 键活化而不是亲核攻击成为决定速率的步骤。我们表明,最初被认为是 α-氟代羧酸降解酶的 FAcD 可以催化二氟乙酸盐脱氟为乙醛酸盐,我们的高分辨率质谱实验捕获了这一过程。此外,我们采用氨基酸静电分析方法来筛选潜在的突变热点,以调整 FAcD 的静电环境以有利于底物转化。对催化机制的全面理解将为合理的酶工程策略提供信息,以降解含氟化合物,从而有利于环境可持续性。对于二氟乙酸酯和三氟乙酸酯,C-F 键活化而不是亲核攻击成为速率决定步骤。我们表明,最初被认为是 α-氟代羧酸降解酶的 FAcD 可以催化二氟乙酸盐脱氟为乙醛酸盐,我们的高分辨率质谱实验捕获了这一过程。此外,我们采用氨基酸静电分析方法来筛选潜在的突变热点,以调整 FAcD 的静电环境以有利于底物转化。对催化机制的全面理解将为合理的酶工程策略提供信息,以降解含氟化合物,从而有利于环境可持续性。对于二氟乙酸酯和三氟乙酸酯,C-F 键活化而不是亲核攻击成为速率决定步骤。我们表明,最初被认为是 α-氟代羧酸降解酶的 FAcD 可以催化二氟乙酸盐脱氟为乙醛酸盐,我们的高分辨率质谱实验捕获了这一过程。此外,我们采用氨基酸静电分析方法来筛选潜在的突变热点,以调整 FAcD 的静电环境以有利于底物转化。对催化机制的全面理解将为合理的酶工程策略提供信息,以降解含氟化合物,从而有利于环境可持续性。最初被认为是 α-氟代羧酸降解酶,可以催化二氟乙酸酯脱氟为乙醛酸,我们的高分辨率质谱实验捕获了这一点。此外,我们采用氨基酸静电分析方法来筛选潜在的突变热点,以调整 FAcD 的静电环境以有利于底物转化。对催化机制的全面理解将为合理的酶工程策略提供信息,以降解含氟化合物,从而有利于环境可持续性。最初被认为是α-氟代羧酸降解酶,可以催化二氟乙酸酯脱氟为乙醛酸酯,我们的高分辨率质谱实验捕获了这一点。此外,我们采用氨基酸静电分析方法来筛选潜在的突变热点,以调整 FAcD 的静电环境以有利于底物转化。对催化机制的全面理解将为合理的酶工程策略提供信息,以降解含氟化合物,从而有利于环境可持续性。我们采用氨基酸静电分析方法来筛选潜在的突变热点,以调整 FAcD 的静电环境以有利于底物转化。对催化机制的全面理解将为合理的酶工程策略提供信息,以降解含氟化合物,从而有利于环境可持续性。我们采用氨基酸静电分析方法来筛选潜在的突变热点,以调整 FAcD 的静电环境以有利于底物转化。对催化机制的全面理解将为合理的酶工程策略提供信息,以降解含氟化合物,从而有利于环境可持续性。
更新日期:2021-07-20
中文翻译:

全面了解氟乙酸脱卤酶催化的氟羧酸降解:QM/MM 方法
含氟化合物是在环境中广泛存在的持久性、生物累积性和有毒化合物。开发有效的生物降解策略以通过破坏惰性 C-F 键来分解含氟化合物是一项整体挑战。作为一种有前景的生物降解酶候选物,氟乙酸脱卤酶 (FAcD) 已被报道为唯一一种催化强 C-F 键断裂的非金属酶。在这里,我们使用分子动力学模拟和量子机制/分子机制计算系统地研究了 FAcD 对其天然底物氟乙酸酯的催化作用。我们建议酶促转化包括四个基本步骤,(I)C-F 键激活,(II)亲核攻击,(III)C-O 键断裂和(IV)质子转移。我们的结果表明亲核攻击是决定速率的步骤。然而,对于二氟乙酸酯和三氟乙酸酯,C-F 键活化而不是亲核攻击成为决定速率的步骤。我们表明,最初被认为是 α-氟代羧酸降解酶的 FAcD 可以催化二氟乙酸盐脱氟为乙醛酸盐,我们的高分辨率质谱实验捕获了这一过程。此外,我们采用氨基酸静电分析方法来筛选潜在的突变热点,以调整 FAcD 的静电环境以有利于底物转化。对催化机制的全面理解将为合理的酶工程策略提供信息,以降解含氟化合物,从而有利于环境可持续性。对于二氟乙酸酯和三氟乙酸酯,C-F 键活化而不是亲核攻击成为速率决定步骤。我们表明,最初被认为是 α-氟代羧酸降解酶的 FAcD 可以催化二氟乙酸盐脱氟为乙醛酸盐,我们的高分辨率质谱实验捕获了这一过程。此外,我们采用氨基酸静电分析方法来筛选潜在的突变热点,以调整 FAcD 的静电环境以有利于底物转化。对催化机制的全面理解将为合理的酶工程策略提供信息,以降解含氟化合物,从而有利于环境可持续性。对于二氟乙酸酯和三氟乙酸酯,C-F 键活化而不是亲核攻击成为速率决定步骤。我们表明,最初被认为是 α-氟代羧酸降解酶的 FAcD 可以催化二氟乙酸盐脱氟为乙醛酸盐,我们的高分辨率质谱实验捕获了这一过程。此外,我们采用氨基酸静电分析方法来筛选潜在的突变热点,以调整 FAcD 的静电环境以有利于底物转化。对催化机制的全面理解将为合理的酶工程策略提供信息,以降解含氟化合物,从而有利于环境可持续性。最初被认为是 α-氟代羧酸降解酶,可以催化二氟乙酸酯脱氟为乙醛酸,我们的高分辨率质谱实验捕获了这一点。此外,我们采用氨基酸静电分析方法来筛选潜在的突变热点,以调整 FAcD 的静电环境以有利于底物转化。对催化机制的全面理解将为合理的酶工程策略提供信息,以降解含氟化合物,从而有利于环境可持续性。最初被认为是α-氟代羧酸降解酶,可以催化二氟乙酸酯脱氟为乙醛酸酯,我们的高分辨率质谱实验捕获了这一点。此外,我们采用氨基酸静电分析方法来筛选潜在的突变热点,以调整 FAcD 的静电环境以有利于底物转化。对催化机制的全面理解将为合理的酶工程策略提供信息,以降解含氟化合物,从而有利于环境可持续性。我们采用氨基酸静电分析方法来筛选潜在的突变热点,以调整 FAcD 的静电环境以有利于底物转化。对催化机制的全面理解将为合理的酶工程策略提供信息,以降解含氟化合物,从而有利于环境可持续性。我们采用氨基酸静电分析方法来筛选潜在的突变热点,以调整 FAcD 的静电环境以有利于底物转化。对催化机制的全面理解将为合理的酶工程策略提供信息,以降解含氟化合物,从而有利于环境可持续性。

































 京公网安备 11010802027423号
京公网安备 11010802027423号