Current Gene Therapy ( IF 3.8 ) Pub Date : 2021-09-30 , DOI: 10.2174/1566523221666210126152000 Rafael Lani-Louzada 1 , Mariana Santana Dias 1 , Rafael Linden 1 , Vinicius Toledo Ribas 2 , Hilda Petrs-Silva 1
|
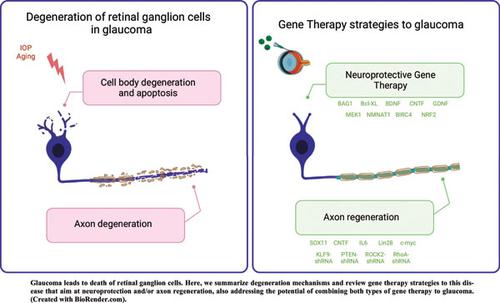
青光眼会导致不可逆转的视力丧失,目前的治疗策略通常不足以防止疾病的进展和随之而来的失明。眼压升高是一个重要的危险因素,但不是青光眼神经变性进展所必需的。视网膜神经节细胞的消亡代表了青光眼视力丧失的最终共同途径。尽管如此,终生控制眼压是目前唯一可以预防严重视力丧失的治疗方法,尽管尽管有最佳实践,但它经常失败。这种情况需要开发针对视网膜神经节细胞以及视神经的神经保护和促再生疗法。几项实验研究表明基因调节作为神经保护和再生工具的潜力。在这种情况下,作为青光眼的持久治疗,基因疗法代表了一种有吸引力的方法。在实验模型中,为促进多种细胞因子过度表达而设计的病毒载体已被证明可以保护视网膜神经节细胞和/或促进轴突再生。在这里,我们回顾了中枢神经系统中青光眼神经变性和再生所涉及的机制。然后,我们指出了基因治疗平台目前的局限性,并回顾了无数使用病毒载体操纵视网膜神经节细胞基因的研究,作为促进神经保护和再生的策略。最后,我们讨论了将神经保护和再生基因疗法结合起来作为青光眼神经退行性疾病的一种方法的潜力。在实验模型中,为促进多种细胞因子过度表达而设计的病毒载体已被证明可以保护视网膜神经节细胞和/或促进轴突再生。在这里,我们回顾了中枢神经系统中青光眼神经变性和再生所涉及的机制。然后,我们指出了基因治疗平台目前的局限性,并回顾了无数使用病毒载体操纵视网膜神经节细胞基因的研究,作为促进神经保护和再生的策略。最后,我们讨论了将神经保护和再生基因疗法结合起来作为青光眼神经退行性疾病的一种方法的潜力。在实验模型中,为促进多种细胞因子过度表达而设计的病毒载体已被证明可以保护视网膜神经节细胞和/或促进轴突再生。在这里,我们回顾了中枢神经系统中青光眼神经变性和再生所涉及的机制。然后,我们指出了基因治疗平台目前的局限性,并回顾了无数使用病毒载体操纵视网膜神经节细胞基因的研究,作为促进神经保护和再生的策略。最后,我们讨论了将神经保护和再生基因疗法结合起来作为青光眼神经退行性疾病的一种方法的潜力。我们回顾了中枢神经系统青光眼神经变性和再生的机制。然后,我们指出了基因治疗平台目前的局限性,并回顾了无数使用病毒载体操纵视网膜神经节细胞基因的研究,作为促进神经保护和再生的策略。最后,我们讨论了将神经保护和再生基因疗法结合起来作为青光眼神经退行性疾病的一种方法的潜力。我们回顾了中枢神经系统青光眼神经变性和再生的机制。然后,我们指出了基因治疗平台目前的局限性,并回顾了无数使用病毒载体操纵视网膜神经节细胞基因的研究,作为促进神经保护和再生的策略。最后,我们讨论了将神经保护和再生基因疗法结合起来作为青光眼神经退行性疾病的一种方法的潜力。

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号