Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Structural basis for substrate specificity of the peroxisomal acyl-CoA hydrolase MpaH’ involved in mycophenolic acid biosynthesis
The FEBS Journal ( IF 5.5 ) Pub Date : 2021-04-12 , DOI: 10.1111/febs.15874
Cai You 1 , Fengwei Li 1 , Xingwang Zhang 1 , Li Ma 1 , Yu‐Zhong Zhang 1 , Wei Zhang 1 , Shengying Li 1, 2
The FEBS Journal ( IF 5.5 ) Pub Date : 2021-04-12 , DOI: 10.1111/febs.15874
Cai You 1 , Fengwei Li 1 , Xingwang Zhang 1 , Li Ma 1 , Yu‐Zhong Zhang 1 , Wei Zhang 1 , Shengying Li 1, 2
Affiliation
|
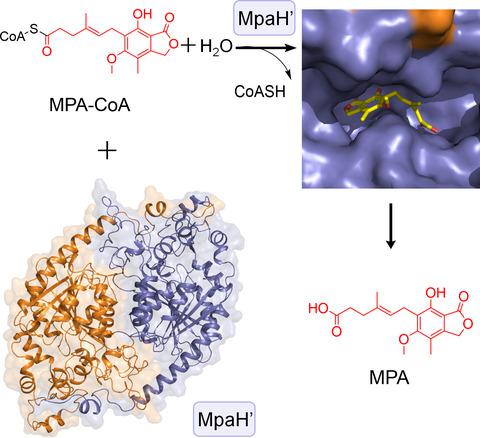
Mycophenolic acid (MPA) is a fungal natural product and first-line immunosuppressive drug for organ transplantations and autoimmune diseases. In the compartmentalized biosynthesis of MPA, the acyl-coenzyme A (CoA) hydrolase MpaH' located in peroxisomes catalyzes the highly specific hydrolysis of MPA-CoA to produce the final product MPA. The strict substrate specificity of MpaH' not only averts undesired hydrolysis of various cellular acyl-CoAs, but also prevents MPA-CoA from further peroxisomal β-oxidation catabolism. To elucidate the structural basis for this important property, in this study, we solve the crystal structures of the substrate-free form of MpaH' and the MpaH'S139A mutant in complex with the product MPA. The MpaH' structure reveals a canonical α/β-hydrolase fold with an unusually large cap domain and a rare location of the acidic residue D163 of catalytic triad after strand β6. MpaH' also forms an atypical dimer with the unique C-terminal helices α13 and α14 arming the cap domain of the other protomer and indirectly participating in the substrate binding. With these characteristics, we propose that MpaH' and its homologs form a new subfamily of α/β hydrolase fold protein. The crystal structure of MpaH'S139A/MPA complex and the modeled structure of MpaH'/MPA-CoA, together with the structure-guided mutagenesis analysis and isothermal titration calorimetry (ITC) measurements, provide important mechanistic insights into the high substrate specificity of MpaH'.
中文翻译:

参与霉酚酸生物合成的过氧化物酶体酰基辅酶A水解酶MpaH'底物特异性的结构基础
霉酚酸(MPA)是一种真菌天然产物,是器官移植和自身免疫性疾病的一线免疫抑制药物。在 MPA 的区室化生物合成中,位于过氧化物酶体中的酰基辅酶 A (CoA) 水解酶 MpaH' 催化 MPA-CoA 的高度特异性水解以产生最终产物 MPA。MpaH' 严格的底物特异性不仅可以避免各种细胞酰基辅酶 A 发生不希望的水解,还可以防止 MPA-CoA 进一步进行过氧化物酶体β-氧化分解代谢。为了阐明这一重要特性的结构基础,在本研究中,我们解决了无底物形式的 MpaH' 和 MpaH' S139A突变体与产物 MPA 复合物的晶体结构。MpaH' 结构揭示了一个典型的α/ β-水解酶折叠具有异常大的帽结构域和β 6链后催化三联体酸性残基 D163 的罕见位置。MpaH' 也形成非典型二聚体,具有独特的C末端螺旋α 13 和α 14 武装帽另一个原体的结构域并间接参与底物结合。有了这些特征,我们提出 MpaH' 及其同源物形成了一个新的α / β水解酶折叠蛋白亚家族。MpaH' S139A的晶体结构/MPA 复合物和 MpaH'/MPA-CoA 的模型结构,以及结构引导的诱变分析和等温滴定量热 (ITC) 测量,为 MpaH' 的高底物特异性提供了重要的机制见解。
更新日期:2021-04-12
中文翻译:

参与霉酚酸生物合成的过氧化物酶体酰基辅酶A水解酶MpaH'底物特异性的结构基础
霉酚酸(MPA)是一种真菌天然产物,是器官移植和自身免疫性疾病的一线免疫抑制药物。在 MPA 的区室化生物合成中,位于过氧化物酶体中的酰基辅酶 A (CoA) 水解酶 MpaH' 催化 MPA-CoA 的高度特异性水解以产生最终产物 MPA。MpaH' 严格的底物特异性不仅可以避免各种细胞酰基辅酶 A 发生不希望的水解,还可以防止 MPA-CoA 进一步进行过氧化物酶体β-氧化分解代谢。为了阐明这一重要特性的结构基础,在本研究中,我们解决了无底物形式的 MpaH' 和 MpaH' S139A突变体与产物 MPA 复合物的晶体结构。MpaH' 结构揭示了一个典型的α/ β-水解酶折叠具有异常大的帽结构域和β 6链后催化三联体酸性残基 D163 的罕见位置。MpaH' 也形成非典型二聚体,具有独特的C末端螺旋α 13 和α 14 武装帽另一个原体的结构域并间接参与底物结合。有了这些特征,我们提出 MpaH' 及其同源物形成了一个新的α / β水解酶折叠蛋白亚家族。MpaH' S139A的晶体结构/MPA 复合物和 MpaH'/MPA-CoA 的模型结构,以及结构引导的诱变分析和等温滴定量热 (ITC) 测量,为 MpaH' 的高底物特异性提供了重要的机制见解。

































 京公网安备 11010802027423号
京公网安备 11010802027423号