当前位置:
X-MOL 学术
›
J. Proteome Res.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Proteome-Wide Analysis of Protein Lysine N-Homocysteinylation in Saccharomyces cerevisiae
Journal of Proteome Research ( IF 3.8 ) Pub Date : 2021-04-02 , DOI: 10.1021/acs.jproteome.0c00937
Joanna Perl A-Kaján 1 , Agata Malinowska 2 , Jarosl Aw Zimny 1 , Dominik Cysewski 2 , Joanna Suszyńska-Zajczyk 1 , Hieronim Jakubowski 1, 3
Journal of Proteome Research ( IF 3.8 ) Pub Date : 2021-04-02 , DOI: 10.1021/acs.jproteome.0c00937
Joanna Perl A-Kaján 1 , Agata Malinowska 2 , Jarosl Aw Zimny 1 , Dominik Cysewski 2 , Joanna Suszyńska-Zajczyk 1 , Hieronim Jakubowski 1, 3
Affiliation
|
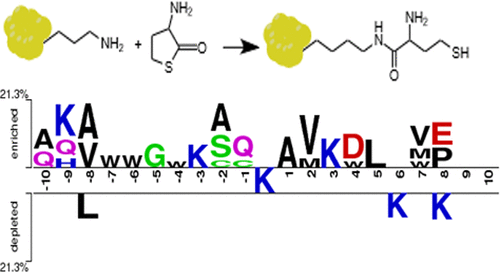
Protein N-homocysteinylation by a homocysteine (Hcy) metabolite, Hcy-thiolactone, is an emerging post-translational modification (PTM) that occurs in all tested organisms and has been linked to human diseases. The yeast Saccharomyces cerevisiae is widely used as a model eukaryotic organism in biomedical research, including studies of protein PTMs. However, patterns of global protein N-homocysteinylation in yeast are not known. Here, we identified 68 in vivo and 197 in vitro N-homocysteinylation sites at protein lysine residues (N-Hcy-Lys). Some of the N-homocysteinylation sites overlap with other previously identified PTM sites. Protein N-homocysteinylation in vivo, induced by supplementation of yeast cultures with Hcy, which elevates Hcy-thiolactone levels, was accompanied by significant changes in the levels of 70 yeast proteins (38 up-regulated and 32 down-regulated) involved in the ribosomal structure, amino acid biosynthesis, and basic cellular pathways. Our study provides the first global survey of N-homocysteinylation and accompanying changes in the yeast proteome caused by elevated Hcy level. These findings suggest that protein N-homocysteinylation and dysregulation of cellular proteostasis may contribute to the toxicity of Hcy in yeast. Homologous proteins and N-homocysteinylation sites are likely to be involved in Hcy-related pathophysiology in humans and experimental animals. Data are available via ProteomeXchange with identifier PXD020821.
中文翻译:

酿酒酵母中蛋白质赖氨酸 N-同型半胱氨酸化的全蛋白质组分析
由同型半胱氨酸 (Hcy) 代谢物 Hcy-硫内酯引起的蛋白质N-同型半胱氨酸化是一种新兴的翻译后修饰 (PTM),它发生在所有测试的生物体中,并且与人类疾病有关。酵母酿酒酵母被广泛用作生物医学研究中的模型真核生物,包括蛋白质翻译后修饰的研究。然而,酵母中全球蛋白质N-同型半胱氨酸化的模式尚不清楚。在这里,我们在蛋白质赖氨酸残基 ( N -Hcy-Lys)处鉴定了 68个体内和 197个体外 N-同型半胱氨酸化位点。一些N-同型半胱氨酸化位点与其他先前确定的 PTM 位点重叠。蛋白质N-体内同型半胱氨酸化,由酵母培养物补充 Hcy(提高Hcy-硫内酯水平)诱导,伴随着核糖体结构中 70 种酵母蛋白(38 种上调和 32 种下调)水平的显着变化,氨基酸生物合成和基本细胞途径。我们的研究提供了第一次全球调查N-同型半胱氨酸化以及由 Hcy 水平升高引起的酵母蛋白质组的伴随变化。这些发现表明蛋白质N-同型半胱氨酸化和细胞蛋白稳态失调可能导致Hcy在酵母中的毒性。同源蛋白质和N-同型半胱氨酸化位点可能参与人类和实验动物的 Hcy 相关病理生理学。数据可通过 ProteomeXchange 获得,标识符为 PXD020821。
更新日期:2021-05-07
中文翻译:

酿酒酵母中蛋白质赖氨酸 N-同型半胱氨酸化的全蛋白质组分析
由同型半胱氨酸 (Hcy) 代谢物 Hcy-硫内酯引起的蛋白质N-同型半胱氨酸化是一种新兴的翻译后修饰 (PTM),它发生在所有测试的生物体中,并且与人类疾病有关。酵母酿酒酵母被广泛用作生物医学研究中的模型真核生物,包括蛋白质翻译后修饰的研究。然而,酵母中全球蛋白质N-同型半胱氨酸化的模式尚不清楚。在这里,我们在蛋白质赖氨酸残基 ( N -Hcy-Lys)处鉴定了 68个体内和 197个体外 N-同型半胱氨酸化位点。一些N-同型半胱氨酸化位点与其他先前确定的 PTM 位点重叠。蛋白质N-体内同型半胱氨酸化,由酵母培养物补充 Hcy(提高Hcy-硫内酯水平)诱导,伴随着核糖体结构中 70 种酵母蛋白(38 种上调和 32 种下调)水平的显着变化,氨基酸生物合成和基本细胞途径。我们的研究提供了第一次全球调查N-同型半胱氨酸化以及由 Hcy 水平升高引起的酵母蛋白质组的伴随变化。这些发现表明蛋白质N-同型半胱氨酸化和细胞蛋白稳态失调可能导致Hcy在酵母中的毒性。同源蛋白质和N-同型半胱氨酸化位点可能参与人类和实验动物的 Hcy 相关病理生理学。数据可通过 ProteomeXchange 获得,标识符为 PXD020821。

































 京公网安备 11010802027423号
京公网安备 11010802027423号