当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
通过ZEB2的EphrinB2抑制介导肿瘤侵袭和抗血管生成抗性。
Nature Communications ( IF 14.7 ) Pub Date : 2016-07-29 , DOI: 10.1038/ncomms12329
C. Depner , H. zum Buttel , N. Böğürcü , A. M. Cuesta , M. R. Aburto , S. Seidel , F. Finkelmeier , F. Foss , J. Hofmann , K. Kaulich , S. Barbus , M. Segarra , G. Reifenberger , B. K. Garvalov , T. Acker , A. Acker-Palmer
Nature Communications ( IF 14.7 ) Pub Date : 2016-07-29 , DOI: 10.1038/ncomms12329
C. Depner , H. zum Buttel , N. Böğürcü , A. M. Cuesta , M. R. Aburto , S. Seidel , F. Finkelmeier , F. Foss , J. Hofmann , K. Kaulich , S. Barbus , M. Segarra , G. Reifenberger , B. K. Garvalov , T. Acker , A. Acker-Palmer
|
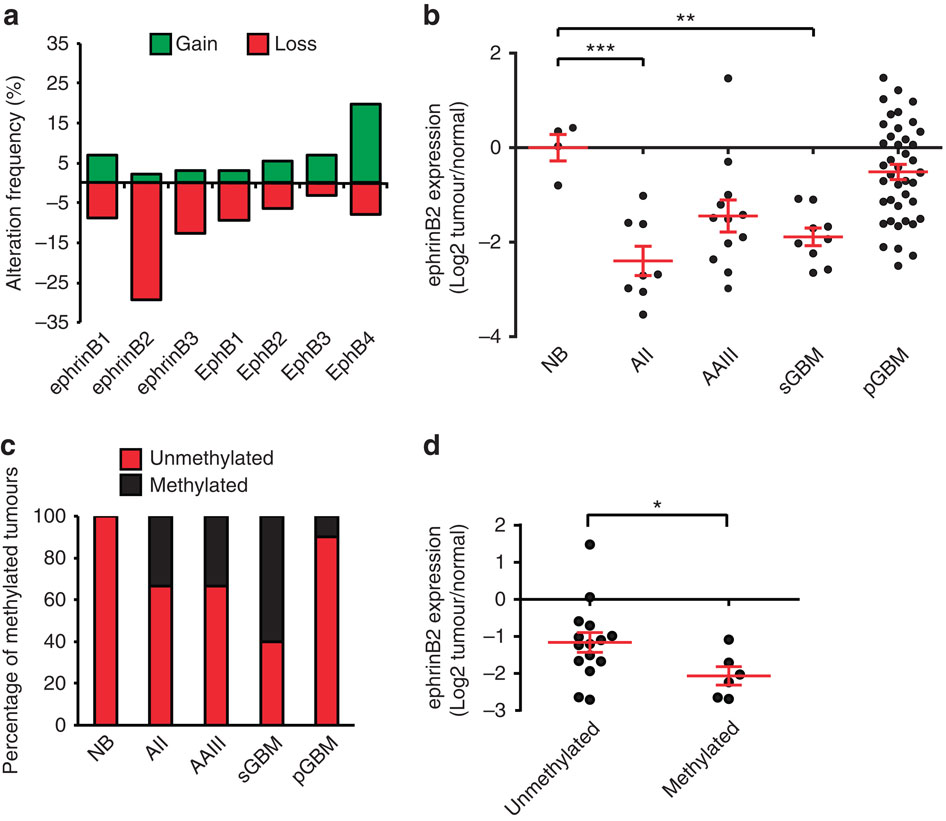
周围脑实质的弥漫性侵袭是用各种疗法(包括抗血管生成剂)治疗神经胶质瘤的主要障碍。在这里,我们确定ephrinB2的上位/遗传和微环境下调是通过消除排斥信号促进肿瘤侵袭的关键步骤。我们证明,由于启动子过度甲基化和基因缺失,人脑胶质瘤中ephrinB2被下调。一致地,在鼠高级神经胶质瘤模型中ephrinB2的基因缺失增加了侵袭。重要的是,ephrinB2基因沉默被缺氧诱导的转录抑制所补充。从机制上讲,缺氧诱导因子(HIF)-1α诱导EMT阻遏物ZEB2,它通过启动子结合直接下调ephrinB2,从而增强肿瘤的侵袭性。该机制在神经胶质瘤的抗血管生成治疗后被激活,并通过破坏ZEB2活性而被有效地阻断。两者合计,我们的结果确定ZEB2为抑制肿瘤侵袭并抵消由抗血管生成治疗策略诱导的肿瘤耐药机制的有吸引力的治疗靶标。

"点击查看英文标题和摘要"
更新日期:2016-08-01

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号