当前位置:
X-MOL 学术
›
Chem. Sci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
CHIP 介导的 tau 蛋白超泛素化促进其自组装成不溶性 tau 丝
Chemical Science ( IF 7.6 ) Pub Date : 2021-3-17 , DOI: 10.1039/d1sc00586c Ji Hyeon Kim 1 , Jeeyoung Lee 1 , Won Hoon Choi 1 , Seoyoung Park 2 , Seo Hyeong Park 1 , Jung Hoon Lee 2 , Sang Min Lim 3 , Ji Young Mun 4 , Hyun-Soo Cho 5 , Dohyun Han 6 , Young Ho Suh 1, 2 , Min Jae Lee 1, 2
Chemical Science ( IF 7.6 ) Pub Date : 2021-3-17 , DOI: 10.1039/d1sc00586c Ji Hyeon Kim 1 , Jeeyoung Lee 1 , Won Hoon Choi 1 , Seoyoung Park 2 , Seo Hyeong Park 1 , Jung Hoon Lee 2 , Sang Min Lim 3 , Ji Young Mun 4 , Hyun-Soo Cho 5 , Dohyun Han 6 , Young Ho Suh 1, 2 , Min Jae Lee 1, 2
Affiliation
|
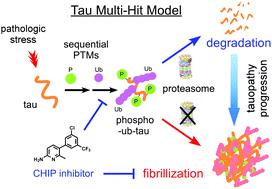
tau 蛋白是一种高度可溶且天然未折叠的蛋白质。在病理条件下,tau 蛋白经历多次翻译后修饰 (PTM) 和构象变化,形成不溶性丝,这是 tau 蛋白病的蛋白质特征。为了剖析聚集过程中 tau PTM 之间的串扰,我们分别使用 GSK3β 和 CHIP在体外磷酸化和泛素化重组 tau。由此产生的磷酸化 ub-tau 包含具有赖氨酸 48 连接的常规多泛素链,足以用于蛋白酶体降解,而未磷酸化的 ub-tau 物种仅保留一到三个泛素部分。对体外重建的磷酸-ub-tau的质谱分析揭示了七个额外的泛素化位点,其中一些已知可以稳定患有 tau 病的人脑中 tau 原丝堆积。当泛素化反应延长时,磷酸-ub-tau 转化为不溶性超泛素化 tau 物种,具有纤维状形态和体外接种活性。我们通过生物物理筛选,开发出CHIP小分子抑制剂;这在体外有效抑制了 tau 泛素化,并延迟了其在培养细胞(包括原代培养神经元)中的聚集。我们的生化发现指向“多重打击模型”,其中 tau 磷酸化和超泛素化的连续事件是纤维化过程的关键驱动因素,因此表明靶向 tau 泛素化可能是缓解 tau 病进程的有效策略。

"点击查看英文标题和摘要"
更新日期:2021-03-17

"点击查看英文标题和摘要"













































 京公网安备 11010802027423号
京公网安备 11010802027423号