当前位置:
X-MOL 学术
›
J. Phys. Chem. B
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
S-亚硝化肌红蛋白的光谱,动力学和水合
The Journal of Physical Chemistry B ( IF 2.8 ) Pub Date : 2021-03-16 , DOI: 10.1021/acs.jpcb.0c10353
Haydar Taylan Turan 1 , Markus Meuwly 1
The Journal of Physical Chemistry B ( IF 2.8 ) Pub Date : 2021-03-16 , DOI: 10.1021/acs.jpcb.0c10353
Haydar Taylan Turan 1 , Markus Meuwly 1
Affiliation
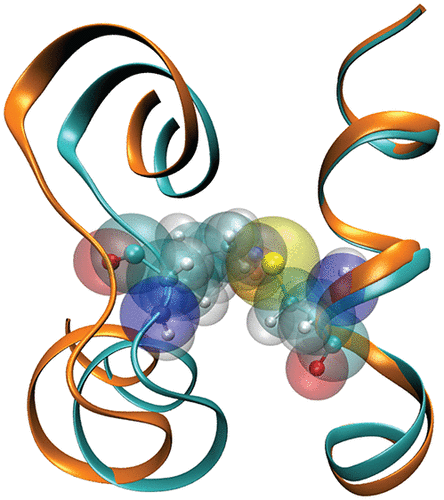
|
S-亚硝基化是NO在半胱氨酸硫醇侧链上的共价添加,是一种重要的过渡后修饰,可改变各种蛋白质的功能。研究了甲基封端的半胱氨酸模型系统和肌红蛋白在缩合相中S-亚硝基化的结构动力学和振动光谱。使用常规的点电荷和-SNO基团在物理上更现实的多极力场,发现SN和NO拉伸以及SNO弯曲振动可以被定位并与其他蛋白质模式区分开来模拟50 MbSNO K.稳定的顺式和反式的发现-MbSNO与对其他蛋白质的实验结果一致,对埋藏的-SNO的观察也是如此。对于MbSNO,在模拟中观察到的EF环的重新定位约3Å与可用的X射线结构一致,并且-SNO标签采用的构象与X射线结构总体上吻合良好。尽管-SNO基团的大小比-SH大,但MbSNO由于更强的静电相互作用,在前两个水合壳中吸收了更多的水分子。同样,当比较A螺旋和H螺旋之间的水合时,WT和MbSNO之间的差异最大为30%。这表明局部水合作用也可以通过亚硝基化来显着调节。

"点击查看英文标题和摘要"
更新日期:2021-05-06

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号