当前位置:
X-MOL 学术
›
Redox Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Crosslinking of human plasma C-reactive protein to human serum albumin via disulfide bond oxidation
Redox Biology ( IF 10.7 ) Pub Date : 2021-03-01 , DOI: 10.1016/j.redox.2021.101925 Shuwen Jiang 1 , Per Hägglund 1 , Luke Carroll 1 , Lars M Rasmussen 2 , Michael J Davies 1
Redox Biology ( IF 10.7 ) Pub Date : 2021-03-01 , DOI: 10.1016/j.redox.2021.101925 Shuwen Jiang 1 , Per Hägglund 1 , Luke Carroll 1 , Lars M Rasmussen 2 , Michael J Davies 1
Affiliation
|
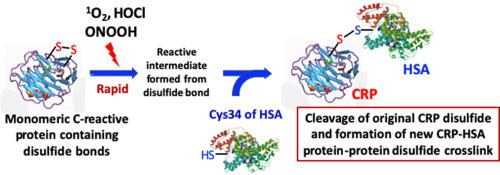
Inter- and intra-molecular crosslinks can generate protein dysfunction, and are associated with protein aggregate accumulation in aged and diseased tissues. Crosslinks formed between multiple amino acid side chains can be reversible or irreversible. Disulfides formed either enzymatically, or as a result of oxidant-mediated reactions, are a major class of reversible crosslinks. Whilst these are commonly generated via oxidation of Cys thiol groups, they are also formed by ‘oxidant-mediated thiol-disulfide reactions’ via initial disulfide oxidation to a thiosulfinate or zwitterionic peroxide, and subsequent reaction with another thiol including those on other proteins. This generates new intermolecular protein-protein crosslinks. Here we demonstrate that photooxidation, or reaction with the biological oxidants HOCl and ONOOH, of the single disulfide present in the major human plasma inflammatory protein, C-reactive protein (CRP) can give rise to reversible disulfide bond formation with human serum albumin (HSA). This occurs in an oxidant dose-, or illumination-time-, dependent manner. These CRP-HSA crosslinks are formed both in isolated protein systems, and in fresh human plasma samples containing high, but not low, levels of CRP. The inter-protein crosslinks which involve Cys36 of CRP and Cys34 of HSA, have been detected by both immunoblotting and mass spectrometry (MS). The yield of protein-protein crosslinks depends on the nature and extent of oxidant exposure, and can be reversed by dithiothreitol and tris(2-carboxyethyl)phosphine hydrochloride. These data indicate that oxidation of disulfide bonds in proteins can be a source of novel inter-protein crosslinks, which may help rationalize the accumulation of crosslinked proteins in aged and diseased tissues.
中文翻译:

通过二硫键氧化将人血浆 C 反应蛋白交联为人血清白蛋白
分子间和分子内交联可产生蛋白质功能障碍,并与衰老和患病组织中蛋白质聚集体的积累有关。多个氨基酸侧链之间形成的交联可以是可逆的或不可逆的。通过酶促或氧化剂介导的反应形成的二硫化物是一类主要的可逆交联。虽然这些通常是通过 Cys 硫醇基团的氧化产生的,但它们也可以通过“氧化剂介导的硫醇-二硫化物反应”形成,即通过最初的二硫化物氧化为硫代亚磺酸盐或两性离子过氧化物,并随后与另一种硫醇(包括其他蛋白质上的硫醇)反应。这会产生新的分子间蛋白质-蛋白质交联。在这里,我们证明,主要人血浆炎症蛋白 C 反应蛋白 (CRP) 中存在的单一二硫键的光氧化作用,或与生物氧化剂 HOCl 和 ONOOH 的反应,可以与人血清白蛋白 (HSA) 形成可逆的二硫键。 )。这以依赖氧化剂剂量或光照时间的方式发生。这些 CRP-HSA 交联在分离的蛋白质系统和含有高但不低水平 CRP 的新鲜人血浆样本中形成。免疫印迹和质谱 (MS) 均检测到涉及 CRP 的 Cys36 和 HSA 的 Cys34 的蛋白质间交联。蛋白质-蛋白质交联的产量取决于氧化剂暴露的性质和程度,并且可以通过二硫苏糖醇和三(2-羧乙基)膦盐酸盐逆转。这些数据表明蛋白质中二硫键的氧化可能是新型蛋白质间交联的来源,这可能有助于合理化老化和患病组织中交联蛋白质的积累。
更新日期:2021-03-01
中文翻译:

通过二硫键氧化将人血浆 C 反应蛋白交联为人血清白蛋白
分子间和分子内交联可产生蛋白质功能障碍,并与衰老和患病组织中蛋白质聚集体的积累有关。多个氨基酸侧链之间形成的交联可以是可逆的或不可逆的。通过酶促或氧化剂介导的反应形成的二硫化物是一类主要的可逆交联。虽然这些通常是通过 Cys 硫醇基团的氧化产生的,但它们也可以通过“氧化剂介导的硫醇-二硫化物反应”形成,即通过最初的二硫化物氧化为硫代亚磺酸盐或两性离子过氧化物,并随后与另一种硫醇(包括其他蛋白质上的硫醇)反应。这会产生新的分子间蛋白质-蛋白质交联。在这里,我们证明,主要人血浆炎症蛋白 C 反应蛋白 (CRP) 中存在的单一二硫键的光氧化作用,或与生物氧化剂 HOCl 和 ONOOH 的反应,可以与人血清白蛋白 (HSA) 形成可逆的二硫键。 )。这以依赖氧化剂剂量或光照时间的方式发生。这些 CRP-HSA 交联在分离的蛋白质系统和含有高但不低水平 CRP 的新鲜人血浆样本中形成。免疫印迹和质谱 (MS) 均检测到涉及 CRP 的 Cys36 和 HSA 的 Cys34 的蛋白质间交联。蛋白质-蛋白质交联的产量取决于氧化剂暴露的性质和程度,并且可以通过二硫苏糖醇和三(2-羧乙基)膦盐酸盐逆转。这些数据表明蛋白质中二硫键的氧化可能是新型蛋白质间交联的来源,这可能有助于合理化老化和患病组织中交联蛋白质的积累。

































 京公网安备 11010802027423号
京公网安备 11010802027423号