当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
酵母酒精脱氢酶的低温电子显微镜结构
Biochemistry ( IF 2.9 ) Pub Date : 2021-02-23 , DOI: 10.1021/acs.biochem.0c00921 Sai Rohit Guntupalli 1, 2, 3 , Zhuang Li 3 , Leifu Chang 3 , Bryce V Plapp 4 , Ramaswamy Subramanian 5
Biochemistry ( IF 2.9 ) Pub Date : 2021-02-23 , DOI: 10.1021/acs.biochem.0c00921 Sai Rohit Guntupalli 1, 2, 3 , Zhuang Li 3 , Leifu Chang 3 , Bryce V Plapp 4 , Ramaswamy Subramanian 5
Affiliation
|
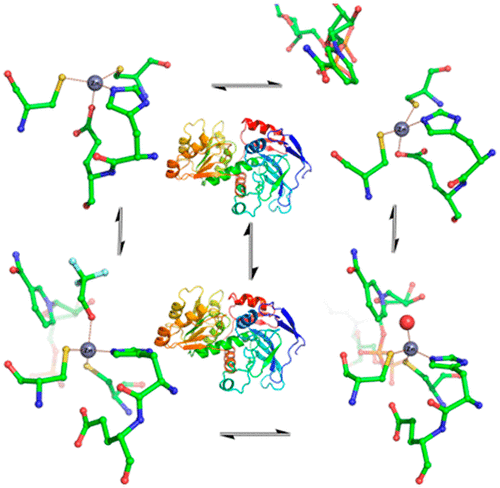
通过X射线晶体学测定的酵母醇脱氢酶的结构表明,亚单位在形成四聚体的两个二聚体的每一个中具有两个不同的构象状态。描述了与催化机理有关的脱辅酶和全酶复合物,但不对称性引发了有关亚基在催化中的协同作用的问题。这项研究使用了冷冻电子显微镜(cryo-EM),为脱辅酶,两种与NADH的二元配合物以及与NAD +和2,2,2-三氟乙醇的三元配合物提供了结构。这些复合物中每一个的所有四个亚基都相同,因为四聚体具有D2对称性,表明不存在预先存在的不对称性,并且亚基可以独立激活。脱辅酶和一种酶-NADH复合物具有“开放”构型,并且催化锌与Cys-43,His-66,Glu-67和Cys-153的配位相反,而另一种酶-NADH复合物和三元复合物具有与锌与Cys-43,His-66,Cys-153以及水或三氟乙醇的氧的经典配位形成闭合构象。构象变化涉及Arg-340与辅酶的焦磷酸基团和Glu-67的相互作用。低温EM和X射线晶体学研究提供了与催化机理相关的结构。

"点击查看英文标题和摘要"
更新日期:2021-03-09

"点击查看英文标题和摘要"






























 京公网安备 11010802027423号
京公网安备 11010802027423号