当前位置:
X-MOL 学术
›
Cancer Sci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
新型驱动基因 ASAP2 是胰腺癌的潜在药物靶点
Cancer Science ( IF 4.5 ) Pub Date : 2021-02-19 , DOI: 10.1111/cas.14858
Atsushi Fujii 1, 2 , Takaaki Masuda 1 , Michio Iwata 3 , Taro Tobo 4 , Hiroaki Wakiyama 1 , Kensuke Koike 1 , Keisuke Kosai 1 , Takafumi Nakano 1 , Shotaro Kuramitsu 1 , Akihiro Kitagawa 1 , Kuniaki Sato 1 , Yuta Kouyama 1 , Dai Shimizu 1 , Yoshihiro Matsumoto 1 , Tohru Utsunomiya 5 , Takao Ohtsuka 6 , Yoshihiro Yamanishi 3 , Masafumi Nakamura 2 , Koshi Mimori 1
Cancer Science ( IF 4.5 ) Pub Date : 2021-02-19 , DOI: 10.1111/cas.14858
Atsushi Fujii 1, 2 , Takaaki Masuda 1 , Michio Iwata 3 , Taro Tobo 4 , Hiroaki Wakiyama 1 , Kensuke Koike 1 , Keisuke Kosai 1 , Takafumi Nakano 1 , Shotaro Kuramitsu 1 , Akihiro Kitagawa 1 , Kuniaki Sato 1 , Yuta Kouyama 1 , Dai Shimizu 1 , Yoshihiro Matsumoto 1 , Tohru Utsunomiya 5 , Takao Ohtsuka 6 , Yoshihiro Yamanishi 3 , Masafumi Nakamura 2 , Koshi Mimori 1
Affiliation
|
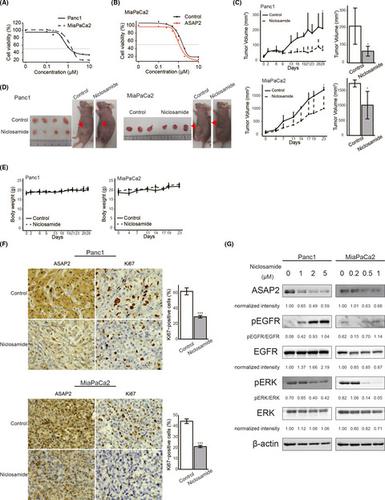
针对突变癌基因是治疗癌症的有效方法。胰腺导管腺癌 (PDAC) 的 4 个主要驱动基因是KRAS、TP53、CDKN2A和SMAD4,统称为 PDAC 的“四大”,但它们仍然是具有挑战性的治疗靶点。在本研究中, ArfGAP 家族之一的具有 SH3 结构域、锚蛋白重复序列和 PH 结构域 2 ( ASAP2 ) 的 ArfGAP 被确定为 PDAC 中的新型驱动基因。PDAC 数据集的临床分析表明,由于 DNA 拷贝数增加,ASAP2在 PDAC 细胞中过度表达,并且ASAP2高表达导致 PDAC 预后不良。使用通过 CRISPR-Cas9 技术产生的ASAP2敲除 PDAC 细胞或转染的 PDAC 细胞研究了ASAP2的生物学作用。体外和体内分析表明,ASAP2 通过表皮生长因子受体 (EGFR) 的磷酸化促进细胞周期进程,从而促进肿瘤生长。使用生物信息学方法鉴定了针对 ASAP2 途径的重新定位药物。基因扰动相关方法表明,抗寄生虫药氯硝柳胺通过抑制 ASAP2 表达来抑制 PDAC 生长。这些数据表明ASAP2是一种新型药物驱动基因,可激活 EGFR 信号通路。此外,氯硝柳胺被确定为可能针对 ASAP2 的 PDAC 重新定位治疗剂。

"点击查看英文标题和摘要"
更新日期:2021-04-04

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号