当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
折叠的II型PLP依赖酶从核杆菌中起丝氨酸合酶和半胱氨酸合酶的作用
Biochemistry ( IF 2.9 ) Pub Date : 2021-02-04 , DOI: 10.1021/acs.biochem.0c00902 Amanda L. Darbyshire 1 , Robert G. Mothersole 1 , Kirsten R. Wolthers 1
Biochemistry ( IF 2.9 ) Pub Date : 2021-02-04 , DOI: 10.1021/acs.biochem.0c00902 Amanda L. Darbyshire 1 , Robert G. Mothersole 1 , Kirsten R. Wolthers 1
Affiliation
|
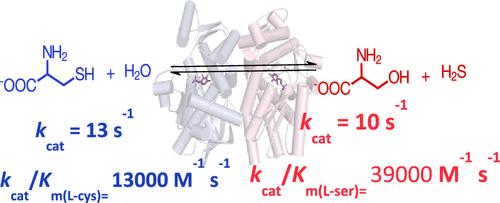
从丝氨酸合酶(SS)具核梭杆菌为折叠类型II的吡哆醛-5'-磷酸(PLP) -依赖性酶,其催化β-更换升用水-半胱氨酸以形成升丝氨酸和H 2 S.此,我们表明该SS也可以用作半胱氨酸合酶,催化β-更换升丝氨酸与二硫化碳以产生升-半胱氨酸和H 2 O的前方(丝氨酸合成酶)和反向与可比的转换数和发生(半胱氨酸合酶)的反应氨基酸底物的催化效率。SS与l的反应-半胱氨酸导致瞬态形成醌型物种,这表明Cα的去质子和β-消除从硫醇盐基团的升-半胱氨酸通过逐步机制发生。相反,在SS与L反应后,在α-氨基丙烯酸酯中间体的形成中未检测到醌类物质。-丝氨酸。已显示出关键的活性位点残基D232可稳定更具化学反应性的酮烯胺PLP互变异构体,并且在正向和反向反应中还充当酸/碱催化剂。PLP和W99(酶的唯一色氨酸残基)之间的荧光共振能量转移,支持配体诱导的活性位点封闭,从而将PLP辅因子与溶剂隔离,并提高了D232的碱性。这些结果提供了新的洞察力,在核糖核酸中的氨基酸代谢,并突出了D232在PLP依赖性酶的II型折叠家族的新成员中的多重催化作用。

"点击查看英文标题和摘要"
更新日期:2021-02-23

"点击查看英文标题和摘要"


















































 京公网安备 11010802027423号
京公网安备 11010802027423号