当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Conformational Motion of Ferredoxin Enables Efficient Electron Transfer to Heme in the Full-Length P450TT
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2021-01-11 , DOI: 10.1021/jacs.0c11279 Zhanfeng Wang 1 , Sason Shaik 2 , Binju Wang 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2021-01-11 , DOI: 10.1021/jacs.0c11279 Zhanfeng Wang 1 , Sason Shaik 2 , Binju Wang 1
Affiliation
|
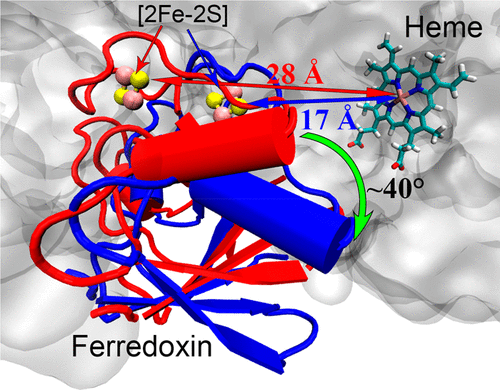
Cytochrome P450 monooxygenases (P450s) are versatile biocatalysts used in natural products biosynthesis, xenobiotic metabolisms, and biotechnologies. In P450s, the electrons required for O2 activation are supplied by NAD(P)H through stepwise electron transfers (ETs) mediated by redox partners. While much is known about the machinery of the catalytic cycle of P450s, the mechanisms of long-range ET are largely unknown. Very recently, the first crystal structure of full-length P450TT was solved. This enables us to decipher the interdomain ET mechanism between the [2Fe-2S]-containing ferredoxin and the heme, by use of molecular dynamics simulations. In contrast to the "distal" conformation characterized in the crystal structure where the [2Fe-2S] cluster is ∼28 Å away from heme-Fe, our simulations demonstrated a "proximal" conformation of [2Fe-2S] that is ∼17 Å [and 13.7 Å edge-to-edge] away from heme-Fe, which may enable the interdomain ET. Key residues involved in ET pathways and interdomain complexation were identified, some of which have already been verified by recent mutation studies. The conformational transit of ferredoxin between "distal" and "proximal" was found to be controlled mostly by the long-range electrostatic interactions between the ferredoxin domain and the other two domains. Furthermore, our simulations show that the full-length P450TT utilizes a flexible ET pathway that resembles either P450Scc or P450cam. Thus, this study provides a uniform picture of the ET process between reductase domains and heme domain.
中文翻译:

铁氧还蛋白的构象运动实现了全长 P450TT 中向血红素的有效电子转移
细胞色素 P450 单加氧酶 (P450) 是用于天然产物生物合成、异生物质代谢和生物技术的多功能生物催化剂。在 P450 中,O2 激活所需的电子由 NAD(P)H 通过氧化还原伙伴介导的逐步电子转移 (ET) 提供。虽然对 P450s 的催化循环机制有很多了解,但远距离 ET 的机制在很大程度上是未知的。最近,全长 P450TT 的第一个晶体结构得到解决。这使我们能够通过使用分子动力学模拟来破译含 [2Fe-2S] 的铁氧还蛋白和血红素之间的域间 ET 机制。与 [2Fe-2S] 簇距血红素-Fe 约 28 埃的晶体结构中表征的“远端”构象相比,我们的模拟证明了“近端”构象 [2Fe-2S] 的构象距血红素-Fe 约 17 Å [和 13.7 Å 边到边],这可能使域间 ET 成为可能。鉴定了涉及 ET 途径和域间复合的关键残基,其中一些已经通过最近的突变研究得到证实。发现铁氧还蛋白在“远端”和“近端”之间的构象传输主要受铁氧还蛋白结构域和其他两个结构域之间的长程静电相互作用控制。此外,我们的模拟表明,全长 P450TT 利用类似于 P450Scc 或 P450cam 的灵活 ET 路径。因此,这项研究提供了还原酶域和血红素域之间 ET 过程的统一图景。鉴定了涉及 ET 途径和域间复合的关键残基,其中一些已经通过最近的突变研究得到证实。发现铁氧还蛋白在“远端”和“近端”之间的构象传输主要受铁氧还蛋白结构域和其他两个结构域之间的长程静电相互作用控制。此外,我们的模拟表明,全长 P450TT 利用类似于 P450Scc 或 P450cam 的灵活 ET 路径。因此,这项研究提供了还原酶域和血红素域之间 ET 过程的统一图景。鉴定了涉及 ET 途径和域间复合的关键残基,其中一些已经通过最近的突变研究得到证实。发现铁氧还蛋白在“远端”和“近端”之间的构象传输主要受铁氧还蛋白结构域和其他两个结构域之间的长程静电相互作用控制。此外,我们的模拟表明,全长 P450TT 利用类似于 P450Scc 或 P450cam 的灵活 ET 路径。因此,这项研究提供了还原酶域和血红素域之间 ET 过程的统一图景。发现主要受铁氧还蛋白结构域和其他两个结构域之间的长程静电相互作用控制。此外,我们的模拟表明,全长 P450TT 利用类似于 P450Scc 或 P450cam 的灵活 ET 路径。因此,这项研究提供了还原酶域和血红素域之间 ET 过程的统一图景。发现主要受铁氧还蛋白结构域和其他两个结构域之间的长程静电相互作用控制。此外,我们的模拟表明,全长 P450TT 利用类似于 P450Scc 或 P450cam 的灵活 ET 路径。因此,这项研究提供了还原酶域和血红素域之间 ET 过程的统一图景。
更新日期:2021-01-11
中文翻译:

铁氧还蛋白的构象运动实现了全长 P450TT 中向血红素的有效电子转移
细胞色素 P450 单加氧酶 (P450) 是用于天然产物生物合成、异生物质代谢和生物技术的多功能生物催化剂。在 P450 中,O2 激活所需的电子由 NAD(P)H 通过氧化还原伙伴介导的逐步电子转移 (ET) 提供。虽然对 P450s 的催化循环机制有很多了解,但远距离 ET 的机制在很大程度上是未知的。最近,全长 P450TT 的第一个晶体结构得到解决。这使我们能够通过使用分子动力学模拟来破译含 [2Fe-2S] 的铁氧还蛋白和血红素之间的域间 ET 机制。与 [2Fe-2S] 簇距血红素-Fe 约 28 埃的晶体结构中表征的“远端”构象相比,我们的模拟证明了“近端”构象 [2Fe-2S] 的构象距血红素-Fe 约 17 Å [和 13.7 Å 边到边],这可能使域间 ET 成为可能。鉴定了涉及 ET 途径和域间复合的关键残基,其中一些已经通过最近的突变研究得到证实。发现铁氧还蛋白在“远端”和“近端”之间的构象传输主要受铁氧还蛋白结构域和其他两个结构域之间的长程静电相互作用控制。此外,我们的模拟表明,全长 P450TT 利用类似于 P450Scc 或 P450cam 的灵活 ET 路径。因此,这项研究提供了还原酶域和血红素域之间 ET 过程的统一图景。鉴定了涉及 ET 途径和域间复合的关键残基,其中一些已经通过最近的突变研究得到证实。发现铁氧还蛋白在“远端”和“近端”之间的构象传输主要受铁氧还蛋白结构域和其他两个结构域之间的长程静电相互作用控制。此外,我们的模拟表明,全长 P450TT 利用类似于 P450Scc 或 P450cam 的灵活 ET 路径。因此,这项研究提供了还原酶域和血红素域之间 ET 过程的统一图景。鉴定了涉及 ET 途径和域间复合的关键残基,其中一些已经通过最近的突变研究得到证实。发现铁氧还蛋白在“远端”和“近端”之间的构象传输主要受铁氧还蛋白结构域和其他两个结构域之间的长程静电相互作用控制。此外,我们的模拟表明,全长 P450TT 利用类似于 P450Scc 或 P450cam 的灵活 ET 路径。因此,这项研究提供了还原酶域和血红素域之间 ET 过程的统一图景。发现主要受铁氧还蛋白结构域和其他两个结构域之间的长程静电相互作用控制。此外,我们的模拟表明,全长 P450TT 利用类似于 P450Scc 或 P450cam 的灵活 ET 路径。因此,这项研究提供了还原酶域和血红素域之间 ET 过程的统一图景。发现主要受铁氧还蛋白结构域和其他两个结构域之间的长程静电相互作用控制。此外,我们的模拟表明,全长 P450TT 利用类似于 P450Scc 或 P450cam 的灵活 ET 路径。因此,这项研究提供了还原酶域和血红素域之间 ET 过程的统一图景。































 京公网安备 11010802027423号
京公网安备 11010802027423号