当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
哺乳动物酸性鞘磷脂酶的晶体结构。
Nature Communications ( IF 14.7 ) Pub Date : 2016-07-20 , DOI: 10.1038/ncomms12196 Alexei Gorelik 1, 2 , Katalin Illes 1, 2 , Leonhard X Heinz 3, 4 , Giulio Superti-Furga 3, 4 , Bhushan Nagar 1, 2
Nature Communications ( IF 14.7 ) Pub Date : 2016-07-20 , DOI: 10.1038/ncomms12196 Alexei Gorelik 1, 2 , Katalin Illes 1, 2 , Leonhard X Heinz 3, 4 , Giulio Superti-Furga 3, 4 , Bhushan Nagar 1, 2
Affiliation
|
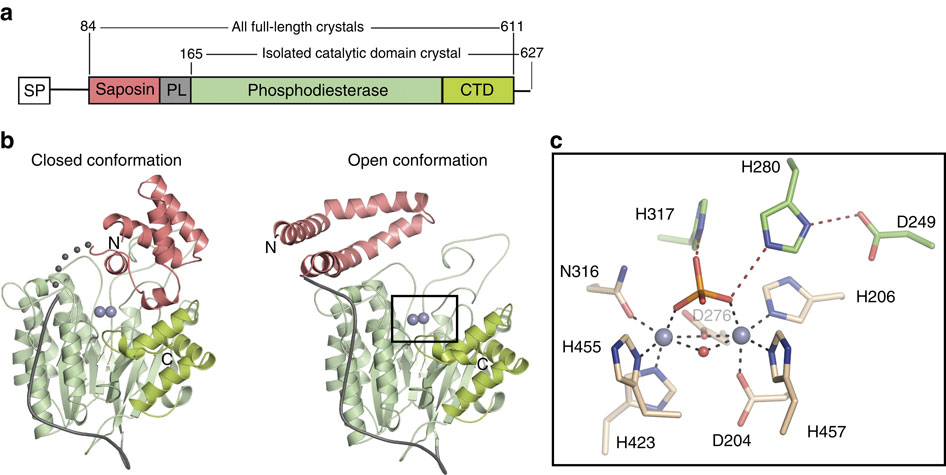
酸性鞘磷脂酶(ASMase、ASM、SMPD1)将鞘磷脂转化为神经酰胺,调节膜特性和信号转导。ASMase 的失活突变会导致尼曼-匹克病,其抑制作用对抑郁症和癌症模型也有益。为了更好地了解这一关键治疗靶点,我们确定了各种构象的哺乳动物 ASMase 的晶体结构。催化结构域采用具有两个锌离子的钙调磷酸酶样折叠和通向活性位点的疏水轨道。引人注目的是,膜相互作用的 saposin 结构域呈现独立于催化结构域的封闭球状构象,或开放构象,它与对活性至关重要的催化结构域建立界面。Niemann-Pick 突变的结构图显示,它们中的大多数可能会破坏蛋白质折叠的稳定性。本研究阐明了ASMase功能的分子机制,为ASMase抑制剂的合理开发和重组ASMase的治疗应用提供了平台。

"点击查看英文标题和摘要"
更新日期:2016-07-23

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号