当前位置:
X-MOL 学术
›
J. Agric. Food Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
β-酪蛋白耗竭的酪蛋白胶束的研究:胶束稳定性,酶交联和作为纳米载体的适用性
Journal of Agricultural and Food Chemistry ( IF 5.7 ) Pub Date : 2020-11-17 , DOI: 10.1021/acs.jafc.0c00904 Anja Duerasch 1 , Pia Herrmann 1 , Konstantin Hogh 1 , Thomas Henle 1
Journal of Agricultural and Food Chemistry ( IF 5.7 ) Pub Date : 2020-11-17 , DOI: 10.1021/acs.jafc.0c00904 Anja Duerasch 1 , Pia Herrmann 1 , Konstantin Hogh 1 , Thomas Henle 1
Affiliation
|
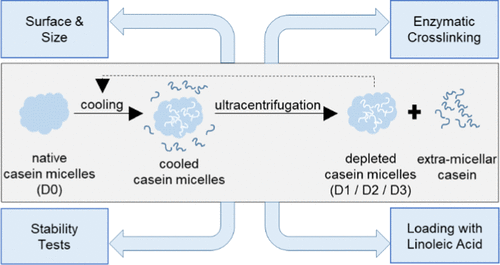
β-酪蛋白是两亲蛋白,因此被认为在酪蛋白胶束中是多边结合的。它的极性分子部分(尤其是磷酸丝氨酸残基)可以与胶体磷酸钙(CCP)发生静电相互作用,形成纳米簇,其非极性分子部分通过与其他酪蛋白形成疏水键来增强胶束稳定性。由于冷却减弱了疏水相互作用,因此可以通过重复的耗竭步骤,包括冷却和随后的超速离心,从酪蛋白胶束中不可逆地除去大部分的β-酪蛋白。尽管数十年来冷却对胶束β-酪蛋白浓度的影响已广为人知,但耗竭对酪蛋白胶束主要特征的影响尚未得到研究。因此,我们旨在分析β-酪蛋白耗竭对酪蛋白胶束稳定性和功能的影响,以评估与天然酪蛋白微胶粒作为纳米载体相比耗竭的情况。通过反复冷却和超速离心步骤不可逆地从天然酪蛋白胶束中分离出高达43.2%的总β-酪蛋白。分别通过动态光散射(DLS)和纳米粒子跟踪分析(NTA)进行测量,耗竭对胶束悬浮液的尺寸分布以及多分散性和颗粒浓度没有影响。此外,胶束对乙醇或螯合剂乙二醇-双(β-氨基乙基醚)-的稳定性 通过反复冷却和超速离心步骤不可逆地从天然酪蛋白胶束中分离出2%的总β-酪蛋白。分别通过动态光散射(DLS)和纳米粒子跟踪分析(NTA)进行测量,耗竭对胶束悬浮液的尺寸分布以及多分散性和颗粒浓度没有影响。此外,胶束对乙醇或螯合剂乙二醇-双(β-氨基乙基醚)-的稳定性 通过反复冷却和超速离心步骤不可逆地从天然酪蛋白胶束中分离出2%的总β-酪蛋白。分别通过动态光散射(DLS)和纳米粒子跟踪分析(NTA)进行测量,耗竭对胶束悬浮液的尺寸分布以及多分散性和颗粒浓度没有影响。此外,胶束对乙醇或螯合剂乙二醇-双(β-氨基乙基醚)-的稳定性N,N,N ',Nβ-酪蛋白耗竭不影响'-四乙酸(EGTA)。尽管如此,耗竭的胶束对微生物转谷氨酰胺酶(mTG)的酶促交联的敏感性较小,表明由于耗竭而导致的水通道变窄。另外,加载实验表明,与天然胶束一样,可以向枯竭的胶束中加载亚油酸(LA)的强度更高,因此,LA可以从天然胶束中置换高达81.3%的β-酪蛋白。我们的结果证实,耗竭不会增强酪蛋白胶束充当疏水性物质的纳米载体的能力,但可以支持对酪蛋白胶束结构的理解。基于观察到的针对EGTA的不变稳定性,受阻的酶促交联以及LA对β-酪蛋白的有效置换,我们建议,胶束β-酪蛋白的主要部分被疏水地结合到胶束结构中,而不会影响磷酸钙纳米簇的形成。因此,β-酪蛋白对酪蛋白胶束结构的主要作用可能是促进内部的高水合作用,从而促进酪蛋白胶束的高渗透性。

"点击查看英文标题和摘要"
更新日期:2020-11-25

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号