当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Curvature-Dependent Binding of Cytochrome c to Cardiolipin
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2020-11-06 , DOI: 10.1021/jacs.0c07301
Margaret M. Elmer-Dixon 1, 2 , Ziqing Xie 1 , Jeremy B. Alverson 1 , Nigel D. Priestley 1 , Bruce E. Bowler 1, 2
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2020-11-06 , DOI: 10.1021/jacs.0c07301
Margaret M. Elmer-Dixon 1, 2 , Ziqing Xie 1 , Jeremy B. Alverson 1 , Nigel D. Priestley 1 , Bruce E. Bowler 1, 2
Affiliation
|
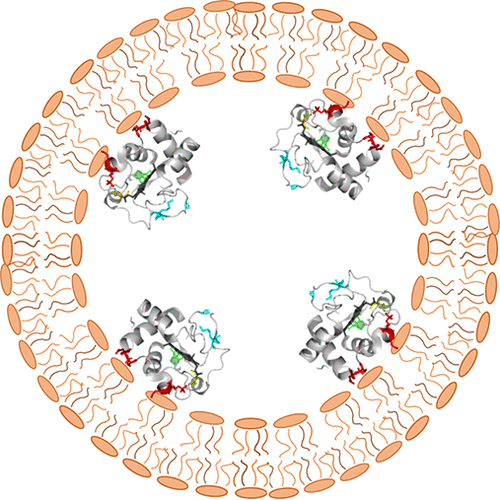
Cytochrome c binds cardiolipin on the concave surface of the inner mitochondrial membrane, before oxidizing the lipid and initiating the apoptotic pathway. This interaction has been studied in vitro, where mimicking the membrane curvature of the binding environment is difficult. Here we report binding to concave, cardiolipin-containing, membrane surfaces and compare findings to convex binding under the same conditions. For binding to the convex outer surface of cardiolipin-containing vesicles, a two-step structural rearrangement is observed with a small rearrangement detectable by Soret circular dichroism (CD) occurring at an exposed lipid-to-protein ratio (LPR) near 10 and partial unfolding detectable by Trp59 fluorescence occurring at an exposed LPR near 23. On the concave inner surface of cardiolipin-containing vesicles, the structural transitions monitored by Soret CD and Trp59 fluorescence are coincident and occur at an exposed LPR near 58. On the concave inner surface of mitochondrial cristae, we estimate the LPR of cardiolipin to cytochrome c is between 50 and 100. Thus, cytochrome c may have adapted to its native environment so that it can undergo a conformational change that switches on its peroxidase activity when it binds to CL-containing membranes in the cristae early in apoptosis. Our results show that membrane curvature qualitatively affects peripheral protein-lipid interactions and also highlights the disparity between in vitro binding studies and their physiological counterparts where cone-shaped lipids, like cardiolipin, are involved.
中文翻译:

细胞色素 c 与心磷脂的曲率依赖性结合
在氧化脂质并启动凋亡途径之前,细胞色素 c 在线粒体内膜的凹面上结合心磷脂。这种相互作用已经在体外进行了研究,其中很难模拟结合环境的膜曲率。在这里,我们报告了与凹面、含心磷脂的膜表面的结合,并将结果与相同条件下的凸面结合进行了比较。为了与含有心磷脂的囊泡的凸面外表面结合,观察到两步结构重排,在暴露的脂质与蛋白质比 (LPR) 接近 10 和部分时,可通过 Soret 圆二色性 (CD) 检测到小的重排展开可通过 Trp59 荧光检测到,发生在 23 附近的暴露 LPR。在含有心磷脂的囊泡的凹形内表面上,Soret CD 和 Trp59 荧光监测的结构转变是重合的,发生在暴露的 LPR 附近 58。在线粒体嵴的凹内表面,我们估计心磷脂到细胞色素 c 的 LPR 在 50 和 100 之间。因此,细胞色素 c 可能已经适应了其天然环境,因此当它在细胞凋亡早期与嵴中含有 CL 的膜结合时,它可以发生构象变化,从而开启其过氧化物酶活性。我们的结果表明,膜曲率定性地影响外周蛋白-脂质相互作用,并且还突出了体外结合研究与其生理学对应物之间的差异,其中涉及锥形脂质,如心磷脂。在线粒体嵴的凹内表面,我们估计心磷脂对细胞色素 c 的 LPR 在 50 到 100 之间。因此,细胞色素 c 可能已经适应了其天然环境,因此它可以经历构象变化,当它在细胞凋亡早期与嵴中含有 CL 的膜结合。我们的结果表明,膜曲率定性地影响外周蛋白-脂质相互作用,并且还突出了体外结合研究与其生理学对应物之间的差异,其中涉及锥形脂质,如心磷脂。在线粒体嵴的凹内表面,我们估计心磷脂对细胞色素 c 的 LPR 在 50 到 100 之间。因此,细胞色素 c 可能已经适应了其天然环境,因此它可以经历构象变化,当它在细胞凋亡早期与嵴中含有 CL 的膜结合。我们的结果表明,膜曲率定性地影响外周蛋白-脂质相互作用,并且还突出了体外结合研究与其生理学对应物之间的差异,其中涉及锥形脂质,如心磷脂。细胞色素 c 可能已经适应了其天然环境,因此当它在细胞凋亡早期与嵴中含有 CL 的膜结合时,它可以发生构象变化,从而开启其过氧化物酶活性。我们的结果表明,膜曲率定性地影响外周蛋白-脂质相互作用,并且还突出了体外结合研究与其生理学对应物之间的差异,其中涉及锥形脂质,如心磷脂。细胞色素 c 可能已经适应了其天然环境,因此当它在细胞凋亡早期与嵴中含有 CL 的膜结合时,它可以发生构象变化,从而开启其过氧化物酶活性。我们的结果表明,膜曲率定性地影响外周蛋白-脂质相互作用,并且还突出了体外结合研究与其生理学对应物之间的差异,其中涉及锥形脂质,如心磷脂。
更新日期:2020-11-06
中文翻译:

细胞色素 c 与心磷脂的曲率依赖性结合
在氧化脂质并启动凋亡途径之前,细胞色素 c 在线粒体内膜的凹面上结合心磷脂。这种相互作用已经在体外进行了研究,其中很难模拟结合环境的膜曲率。在这里,我们报告了与凹面、含心磷脂的膜表面的结合,并将结果与相同条件下的凸面结合进行了比较。为了与含有心磷脂的囊泡的凸面外表面结合,观察到两步结构重排,在暴露的脂质与蛋白质比 (LPR) 接近 10 和部分时,可通过 Soret 圆二色性 (CD) 检测到小的重排展开可通过 Trp59 荧光检测到,发生在 23 附近的暴露 LPR。在含有心磷脂的囊泡的凹形内表面上,Soret CD 和 Trp59 荧光监测的结构转变是重合的,发生在暴露的 LPR 附近 58。在线粒体嵴的凹内表面,我们估计心磷脂到细胞色素 c 的 LPR 在 50 和 100 之间。因此,细胞色素 c 可能已经适应了其天然环境,因此当它在细胞凋亡早期与嵴中含有 CL 的膜结合时,它可以发生构象变化,从而开启其过氧化物酶活性。我们的结果表明,膜曲率定性地影响外周蛋白-脂质相互作用,并且还突出了体外结合研究与其生理学对应物之间的差异,其中涉及锥形脂质,如心磷脂。在线粒体嵴的凹内表面,我们估计心磷脂对细胞色素 c 的 LPR 在 50 到 100 之间。因此,细胞色素 c 可能已经适应了其天然环境,因此它可以经历构象变化,当它在细胞凋亡早期与嵴中含有 CL 的膜结合。我们的结果表明,膜曲率定性地影响外周蛋白-脂质相互作用,并且还突出了体外结合研究与其生理学对应物之间的差异,其中涉及锥形脂质,如心磷脂。在线粒体嵴的凹内表面,我们估计心磷脂对细胞色素 c 的 LPR 在 50 到 100 之间。因此,细胞色素 c 可能已经适应了其天然环境,因此它可以经历构象变化,当它在细胞凋亡早期与嵴中含有 CL 的膜结合。我们的结果表明,膜曲率定性地影响外周蛋白-脂质相互作用,并且还突出了体外结合研究与其生理学对应物之间的差异,其中涉及锥形脂质,如心磷脂。细胞色素 c 可能已经适应了其天然环境,因此当它在细胞凋亡早期与嵴中含有 CL 的膜结合时,它可以发生构象变化,从而开启其过氧化物酶活性。我们的结果表明,膜曲率定性地影响外周蛋白-脂质相互作用,并且还突出了体外结合研究与其生理学对应物之间的差异,其中涉及锥形脂质,如心磷脂。细胞色素 c 可能已经适应了其天然环境,因此当它在细胞凋亡早期与嵴中含有 CL 的膜结合时,它可以发生构象变化,从而开启其过氧化物酶活性。我们的结果表明,膜曲率定性地影响外周蛋白-脂质相互作用,并且还突出了体外结合研究与其生理学对应物之间的差异,其中涉及锥形脂质,如心磷脂。

































 京公网安备 11010802027423号
京公网安备 11010802027423号