当前位置:
X-MOL 学术
›
Plant Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
EcaICE1关键区域和推测的磷酸化位点在与桉树EcaHOS1蛋白的分子相互作用中的表征
Plant Biology ( IF 4.2 ) Pub Date : 2020-10-27 , DOI: 10.1111/plb.13205
L. Cheng 1, 2, 3 , W. Zhang 4 , J. Hu 1, 2 , Z. Zhang 1, 2 , Y. Liu 1, 2 , Y. Lin 1, 2

"点击查看英文标题和摘要"
更新日期:2020-10-27
Plant Biology ( IF 4.2 ) Pub Date : 2020-10-27 , DOI: 10.1111/plb.13205
L. Cheng 1, 2, 3 , W. Zhang 4 , J. Hu 1, 2 , Z. Zhang 1, 2 , Y. Liu 1, 2 , Y. Lin 1, 2
Affiliation
|
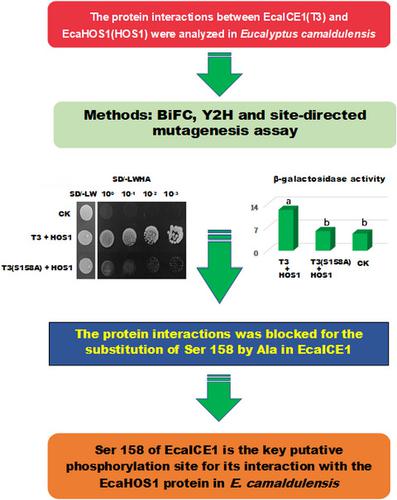
- CBF表达1(ICE1)的诱导物是一种MYC样bHLH转录激活因子,在寒冷胁迫下的植物中起重要作用。拟南芥在寒冷胁迫下,由渗透反应基因1(HOS1)的高表达介导的泛素化-蛋白酶体途径可以有效诱导ICE1的降解并降低CBF及其下游基因的表达,但有关HOS1对ICE1泛素化调控的了解仍然限于木本植物。
- 本研究从Eucalyptus camaldulensis扩增了一个E3泛素连接酶基因EcaHOS1,并分析了EcaICE1和EcaHOS1之间的蛋白质相互作用。
- 酵母双杂交(Y2H)和双分子荧光互补(BiFC)分析结果表明,EcaICE1可以与细胞核中的EcaHOS1蛋白相互作用,此外,Y2H分析表明,EcaICE1可以在N-末端的126-185个氨基酸区域EcaICE1蛋白与EcaHOS1蛋白相互作用是必不可少的。此外,根据生物信息学分析,我们发现关键相互作用区内第145、158和184位的氨基酸是EcaICE1的假定磷酸化位点,只有丙氨酸(Ala)取代丝氨酸(Ser)158才能阻断EcaICE1的磷酸化。基于定点诱变的Y2H和β-半乳糖苷酶活性测定,EcaICE1和EcaHOS1之间的蛋白质相互作用。
- 我们确定EcaICE1的Ser 158是关键推测的磷酸化位点,因为它与EcaHOS1蛋白相互作用。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号