当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
NMP 激酶 AK3 中 GTP 与 ATP 选择性的结构基础。
Biochemistry ( IF 2.9 ) Pub Date : 2020-08-21 , DOI: 10.1021/acs.biochem.0c00549
Per Rogne 1 , Beata Dulko-Smith 2 , Jack Goodman 1 , Marie Rosselin 1 , Christin Grundström 1 , Christian Hedberg 1 , Kwangho Nam 2 , A Elisabeth Sauer-Eriksson 1 , Magnus Wolf-Watz 1
Biochemistry ( IF 2.9 ) Pub Date : 2020-08-21 , DOI: 10.1021/acs.biochem.0c00549
Per Rogne 1 , Beata Dulko-Smith 2 , Jack Goodman 1 , Marie Rosselin 1 , Christin Grundström 1 , Christian Hedberg 1 , Kwangho Nam 2 , A Elisabeth Sauer-Eriksson 1 , Magnus Wolf-Watz 1
Affiliation
|
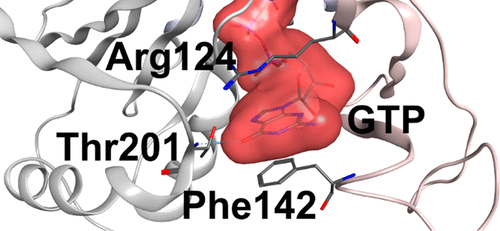
ATP 和 GTP 是生物学中极其重要的分子,具有多种且通常是离散的功能。因此,与它们中的任何一个结合的酶必须开发强大的机制来选择性地利用其中一个。在这里,这个特定的问题通过人类 NMP 激酶 AK3 的分子研究得到解决,该激酶使用 GTP 来磷酸化 AMP。AK3 在柠檬酸循环中起着重要作用,它负责 GTP/GDP 循环。通过将结构生物学方法与功能实验相结合,我们对酶的结构和机理有了全面的了解。我们发现 AK3 通过将 GTP 募集到活性位点而发挥作用,而 ATP 被拒绝并与 AMP 结合位点非生产性地结合。因此,ATP 作为 GTP 和 AMP 的抑制剂。对正确底物的特异性识别和不正确底物的非生产性结合的总体特征与先前对 ATP 特异性 NMP 激酶腺苷酸激酶的发现具有很强的相似性。总之,我们现在能够提供大型 NMP 激酶家族中 GTP 和 ATP 选择性的基本原理。作为源自 GTP 和 ATP 滴定中化学位移非线性的副作用,我们发现蛋白质表面对 GTP 和 ATP 提供了普遍而弱的结合亲和力。这些非特异性相互作用可能会降低可用的细胞内 GTP 和 ATP 浓度,并可能相应地驱动 NMP 激酶的 Michaelis 常数的进化。

"点击查看英文标题和摘要"
更新日期:2020-09-29

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号