当前位置:
X-MOL 学术
›
Macromolecules
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Polyion Complex-Templated Synthesis of Cross-Linked Single-Enzyme Nanoparticles
Macromolecules ( IF 5.1 ) Pub Date : 2020-06-26 , DOI: 10.1021/acs.macromol.0c00528 Yiping Wang 1 , Yen Theng Cheng 1, 2 , Cheng Cao 1 , James D. Oliver 3 , Martina H. Stenzel 1 , Robert Chapman 1, 2
Macromolecules ( IF 5.1 ) Pub Date : 2020-06-26 , DOI: 10.1021/acs.macromol.0c00528 Yiping Wang 1 , Yen Theng Cheng 1, 2 , Cheng Cao 1 , James D. Oliver 3 , Martina H. Stenzel 1 , Robert Chapman 1, 2
Affiliation
|
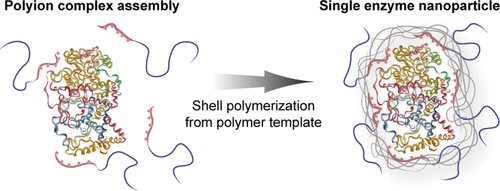
Single-enzyme nanoparticles (SENs), which encapsulate individual enzymes in a thin polymer network, offer exciting possibilities for stabilizing enzymes and tuning their activity, but most approaches to date rely on covalent modification of the enzyme. We introduce here a new approach to their synthesis in which a pre-prepared polymer synthesized by reversible addition-fragmentation chain-transfer polymerization is first tethered to the surface via electrostatic interactions. Isothermal titration calorimetry and asymmetric flow field-flow fraction (AF4) in combination with multiangle light scattering (MALS) reveal weak binding of 2–5 chains/enzymes. The strength of binding can be tuned based on the charge density of the bound polymer. AF4-MALS and small-angle X-ray scattering confirm the formation of a thin cross-linked shell around the enzyme following chain extension of this polymer in the presence of a bis-functional monomer. The mild conditions of this method of SEN formation, which avoids any covalent modification of the enzyme, result in no loss in activity on our model enzyme (glucose oxidase) and 4-fold increase in thermal stability. It offers much greater control over the chemistry of the SEN, which we demonstrate by incorporation of trehalose between the enzyme and cross-linked shell.
中文翻译:

交联单酶纳米粒子的聚离子复合物模板合成
单酶纳米颗粒(SENs)将单个酶包裹在一个薄的聚合物网络中,为稳定酶和调节其活性提供了令人兴奋的可能性,但是迄今为止,大多数方法都依赖于酶的共价修饰。我们在这里介绍一种新的合成方法,其中通过可逆加成-断裂链转移聚合反应合成的预先制备的聚合物首先通过静电相互作用束缚在表面上。等温滴定量热法和不对称流场流动分数(AF4)与多角度光散射(MALS)结合显示2-5个链/酶的弱结合。结合的强度可以基于结合的聚合物的电荷密度来调节。AF4-MALS和小角度X射线散射证实了在双官能单体存在下该聚合物的链增长后,在酶周围形成了薄的交联壳。这种SEN形成方法的温和条件避免了酶的任何共价修饰,不会导致模型酶(葡萄糖氧化酶)的活性下降,热稳定性提高了4倍。它提供了对SEN化学的更大控制,我们通过在酶和交联壳之间掺入海藻糖来证明这一点。不会导致模型酶(葡萄糖氧化酶)的活性降低,热稳定性提高4倍。它提供了对SEN化学的更大控制,我们通过在酶和交联壳之间掺入海藻糖来证明这一点。不会导致模型酶(葡萄糖氧化酶)的活性降低,热稳定性提高4倍。它提供了对SEN化学的更大控制,我们通过在酶和交联壳之间掺入海藻糖来证明这一点。
更新日期:2020-07-14
中文翻译:

交联单酶纳米粒子的聚离子复合物模板合成
单酶纳米颗粒(SENs)将单个酶包裹在一个薄的聚合物网络中,为稳定酶和调节其活性提供了令人兴奋的可能性,但是迄今为止,大多数方法都依赖于酶的共价修饰。我们在这里介绍一种新的合成方法,其中通过可逆加成-断裂链转移聚合反应合成的预先制备的聚合物首先通过静电相互作用束缚在表面上。等温滴定量热法和不对称流场流动分数(AF4)与多角度光散射(MALS)结合显示2-5个链/酶的弱结合。结合的强度可以基于结合的聚合物的电荷密度来调节。AF4-MALS和小角度X射线散射证实了在双官能单体存在下该聚合物的链增长后,在酶周围形成了薄的交联壳。这种SEN形成方法的温和条件避免了酶的任何共价修饰,不会导致模型酶(葡萄糖氧化酶)的活性下降,热稳定性提高了4倍。它提供了对SEN化学的更大控制,我们通过在酶和交联壳之间掺入海藻糖来证明这一点。不会导致模型酶(葡萄糖氧化酶)的活性降低,热稳定性提高4倍。它提供了对SEN化学的更大控制,我们通过在酶和交联壳之间掺入海藻糖来证明这一点。不会导致模型酶(葡萄糖氧化酶)的活性降低,热稳定性提高4倍。它提供了对SEN化学的更大控制,我们通过在酶和交联壳之间掺入海藻糖来证明这一点。




















































 京公网安备 11010802027423号
京公网安备 11010802027423号