当前位置:
X-MOL 学术
›
J. Mol. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Hsp90 N 结构域中的突变可识别酵母中控制二聚体打开并扩展人类 Hsp90α 功能的位点。
Journal of Molecular Biology ( IF 4.7 ) Pub Date : 2020-06-19 , DOI: 10.1016/j.jmb.2020.06.015 Michael Reidy 1 , Daniel C Masison 1
Affiliation
|
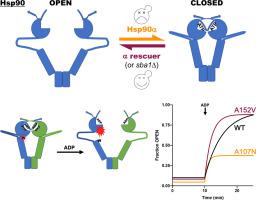
Hsp90 是一种高度保守的分子伴侣,对于许多客户蛋白的活性非常重要。 Hsp90 具有 N 端 ATP 酶结构域 (N)、与客户端相互作用的中间结构域 (M) 和 C 端二聚化结构域 (C)。客户周围二聚体的“闭合”受到 ATP 结合、共伴侣和翻译后修饰的调节。 ATP 水解与成熟客户的释放和重置反应周期同时发生。人类有两个 Hsp90:hHsp90α 和 hHsp90β。尽管 85% 相同,hHsp90β 比 hHsp90α 更好地支持酵母中的 Hsp90 功能。确定这种差异的基础将为了解看似冗余的 Hsp90 的功能特异性以及真核 Hsp90 系统和客户的进化提供重要的见解。在这里,我们发现宿主共伴侣 Sba1、Cpr6 和 Cpr7 抑制酵母中的 hHsp90α 功能,并且我们发现 N 结构域中聚集的突变显着改善了酵母中的 hHsp90α 功能。这些救援突变中最强的一个加速了核苷酸依赖性盖子关闭、N-M 结构域对接和 ATP 酶。它还破坏了与 Sba1 的结合,从而延长了关闭状态,并促进了 N-M 脱扣和盖子打开。我们的数据表明,救援突变通过加速返回开放状态来改善酵母中 hHsp90α 的功能。我们的研究结果表明,hHsp90α 处于封闭状态的时间太长,无法在酵母中有效发挥作用,并定义了参与重置 Hsp90 反应周期的 N 结构域的进化保守区域。

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号