当前位置:
X-MOL 学术
›
Chem. Rev.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Structural Enzymology of Nitrogenase Enzymes.
Chemical Reviews ( IF 51.4 ) Pub Date : 2020-06-15 , DOI: 10.1021/acs.chemrev.0c00067 Oliver Einsle 1 , Douglas C Rees 2
Chemical Reviews ( IF 51.4 ) Pub Date : 2020-06-15 , DOI: 10.1021/acs.chemrev.0c00067 Oliver Einsle 1 , Douglas C Rees 2
Affiliation
|
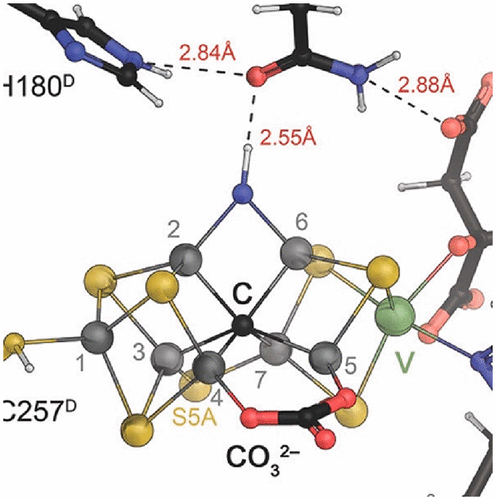
The reduction of dinitrogen to ammonia by nitrogenase reflects a complex choreography involving two component proteins, MgATP and reductant. At center stage of this process resides the active site cofactor, a complex metallocluster organized around a trigonal prismatic arrangement of iron sites surrounding an interstitial carbon. As a consequence of the choreography, electrons and protons are delivered to the active site for transfer to the bound N2. While the detailed mechanism for the substrate reduction remains enigmatic, recent developments highlight the role of hydrides and the privileged role for two irons of the trigonal prism in the binding of exogenous ligands. Outstanding questions concern the precise nature of the intermediates between N2 and NH3, and whether the cofactor undergoes significant rearrangement during turnover; resolution of these issues will require the convergence of biochemistry, structure, spectroscopy, computation, and model chemistry.
中文翻译:

氮酶的结构酶学。
固氮酶将二氮还原为氨反映了一种复杂的编排,涉及两种成分蛋白质,MgATP 和还原剂。在这个过程的中心阶段是活性位点辅助因子,一种复杂的金属团簇,围绕着间隙碳周围的铁位点的三角棱柱排列组织。作为编排的结果,电子和质子被传递到活性位点以转移到结合的N 2。虽然底物还原的详细机制仍然是个谜,但最近的发展突出了氢化物的作用以及三棱柱的两个铁离子在外源性配体结合中的特殊作用。悬而未决的问题涉及 N 2和 NH 3之间的中间体的精确性质,以及辅因子在转换过程中是否经历了显着的重排;这些问题的解决需要生物化学、结构、光谱学、计算和模型化学的融合。
更新日期:2020-06-24
中文翻译:

氮酶的结构酶学。
固氮酶将二氮还原为氨反映了一种复杂的编排,涉及两种成分蛋白质,MgATP 和还原剂。在这个过程的中心阶段是活性位点辅助因子,一种复杂的金属团簇,围绕着间隙碳周围的铁位点的三角棱柱排列组织。作为编排的结果,电子和质子被传递到活性位点以转移到结合的N 2。虽然底物还原的详细机制仍然是个谜,但最近的发展突出了氢化物的作用以及三棱柱的两个铁离子在外源性配体结合中的特殊作用。悬而未决的问题涉及 N 2和 NH 3之间的中间体的精确性质,以及辅因子在转换过程中是否经历了显着的重排;这些问题的解决需要生物化学、结构、光谱学、计算和模型化学的融合。































 京公网安备 11010802027423号
京公网安备 11010802027423号