当前位置:
X-MOL 学术
›
J. Comp. Neurol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Differential temporal and spatial post-injury alterations in cerebral cell morphology and viability.
The Journal of Comparative Neurology ( IF 2.3 ) Pub Date : 2020-05-24 , DOI: 10.1002/cne.24955
Zareen Amtul 1 , Abdullah N Najdat 2 , David J Hill 3, 4 , Edith J Arany 5
The Journal of Comparative Neurology ( IF 2.3 ) Pub Date : 2020-05-24 , DOI: 10.1002/cne.24955
Zareen Amtul 1 , Abdullah N Najdat 2 , David J Hill 3, 4 , Edith J Arany 5
Affiliation
|
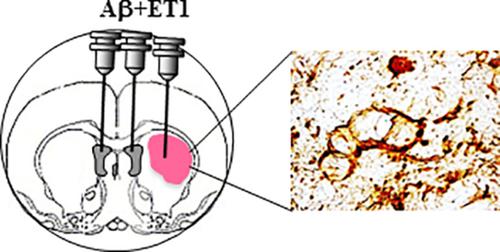
Combination of ischemia and β‐amyloid (Aβ) toxicity has been shown to simultaneously increase neuro‐inflammation, endogenous Aβ deposition, and neurodegeneration. However, studies on the evolution of infarct and panorama of cellular degeneration as a synergistic or overlapping mechanism between ischemia and Aβ toxicity are lacking. Here, we compared fluorojade B (FJB) and hematoxylin and eosin (H&E) stains primarily to examine the chronology of infarct, and the viability and morphological changes in neuroglia and neurons located in different brain regions on d1, d7, and d28 post Aβ toxicity and endothelin‐1 induced ischemia (ET1) in rats. We demonstrated a regional difference in cellular degeneration between cortex, corpus callosum, striatum, globus pallidus, and thalamus after cerebral injury. Glial cells in the cortex and corpus callosum underwent delayed FJB staining from d7 to d28, but neurons in cortex disappeared within the first week of cerebral injury. Striatal lesion core and globus pallidus of Aβ + ET1 rats showed extensive degeneration of neuronal cells compared with ET1 rats alone starting from d1. Differential and exacerbated expressions of cyclooxygenase‐2 might be the cause of excessive neuronal demise in the striatum of Aβ + ET1 rats. Such an investigation may improve our understanding to identify and manipulate a critical therapeutic window post comorbid injury.
中文翻译:

脑细胞形态和活力的不同时间和空间损伤后改变。
缺血和 β-淀粉样蛋白 (Aβ) 毒性的组合已被证明会同时增加神经炎症、内源性 Aβ 沉积和神经变性。然而,作为缺血和 Aβ 毒性之间协同或重叠机制的梗塞演变和细胞变性全景的研究缺乏。在这里,我们比较了氟玉 B (FJB) 和苏木精和伊红 (H&E) 染色,主要是为了检查梗死的时间顺序,以及 Aβ 毒性后 d1、d7 和 d28 位于不同大脑区域的神经胶质和神经元的活力和形态变化和内皮素-1 诱导大鼠缺血(ET1)。我们证明了脑损伤后皮层、胼胝体、纹状体、苍白球和丘脑之间细胞变性的区域差异。皮层和胼胝体中的神经胶质细胞从第 7 天到第 28 天进行延迟 FJB 染色,但皮层中的神经元在脑损伤的第一周内消失。从第 1 天开始,与单独的 ET1 大鼠相比,Aβ + ET1 大鼠的纹状体病变核心和苍白球显示出神经元细胞的广泛变性。环氧合酶-2 的差异表达和加重可能是 Aβ+ET1 大鼠纹状体神经元过度死亡的原因。这样的调查可能会提高我们的理解,以识别和操纵共病损伤后的关键治疗窗口。从第 1 天开始,与单独的 ET1 大鼠相比,Aβ + ET1 大鼠的纹状体病变核心和苍白球显示出神经元细胞的广泛变性。环氧合酶-2 的差异表达和加重可能是 Aβ+ET1 大鼠纹状体神经元过度死亡的原因。这样的调查可能会提高我们的理解,以识别和操纵共病损伤后的关键治疗窗口。从第 1 天开始,与单独的 ET1 大鼠相比,Aβ + ET1 大鼠的纹状体病变核心和苍白球显示出神经元细胞的广泛变性。环氧合酶-2 的差异表达和加重可能是 Aβ+ET1 大鼠纹状体神经元过度死亡的原因。这样的调查可能会提高我们的理解,以识别和操纵共病损伤后的关键治疗窗口。
更新日期:2020-06-29
中文翻译:

脑细胞形态和活力的不同时间和空间损伤后改变。
缺血和 β-淀粉样蛋白 (Aβ) 毒性的组合已被证明会同时增加神经炎症、内源性 Aβ 沉积和神经变性。然而,作为缺血和 Aβ 毒性之间协同或重叠机制的梗塞演变和细胞变性全景的研究缺乏。在这里,我们比较了氟玉 B (FJB) 和苏木精和伊红 (H&E) 染色,主要是为了检查梗死的时间顺序,以及 Aβ 毒性后 d1、d7 和 d28 位于不同大脑区域的神经胶质和神经元的活力和形态变化和内皮素-1 诱导大鼠缺血(ET1)。我们证明了脑损伤后皮层、胼胝体、纹状体、苍白球和丘脑之间细胞变性的区域差异。皮层和胼胝体中的神经胶质细胞从第 7 天到第 28 天进行延迟 FJB 染色,但皮层中的神经元在脑损伤的第一周内消失。从第 1 天开始,与单独的 ET1 大鼠相比,Aβ + ET1 大鼠的纹状体病变核心和苍白球显示出神经元细胞的广泛变性。环氧合酶-2 的差异表达和加重可能是 Aβ+ET1 大鼠纹状体神经元过度死亡的原因。这样的调查可能会提高我们的理解,以识别和操纵共病损伤后的关键治疗窗口。从第 1 天开始,与单独的 ET1 大鼠相比,Aβ + ET1 大鼠的纹状体病变核心和苍白球显示出神经元细胞的广泛变性。环氧合酶-2 的差异表达和加重可能是 Aβ+ET1 大鼠纹状体神经元过度死亡的原因。这样的调查可能会提高我们的理解,以识别和操纵共病损伤后的关键治疗窗口。从第 1 天开始,与单独的 ET1 大鼠相比,Aβ + ET1 大鼠的纹状体病变核心和苍白球显示出神经元细胞的广泛变性。环氧合酶-2 的差异表达和加重可能是 Aβ+ET1 大鼠纹状体神经元过度死亡的原因。这样的调查可能会提高我们的理解,以识别和操纵共病损伤后的关键治疗窗口。

































 京公网安备 11010802027423号
京公网安备 11010802027423号