当前位置:
X-MOL 学术
›
ACS Chem. Neurosci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
α-Synuclein Regulates Iron Homeostasis via Preventing Parkin-Mediated DMT1 Ubiquitylation in Parkinson's Disease Models.
ACS Chemical Neuroscience ( IF 4.1 ) Pub Date : 2020-05-07 , DOI: 10.1021/acschemneuro.0c00196 Mingxia Bi 1 , Xixun Du 1 , Qian Jiao 1 , Zhiguo Liu 1 , Hong Jiang 1
ACS Chemical Neuroscience ( IF 4.1 ) Pub Date : 2020-05-07 , DOI: 10.1021/acschemneuro.0c00196 Mingxia Bi 1 , Xixun Du 1 , Qian Jiao 1 , Zhiguo Liu 1 , Hong Jiang 1
Affiliation
|
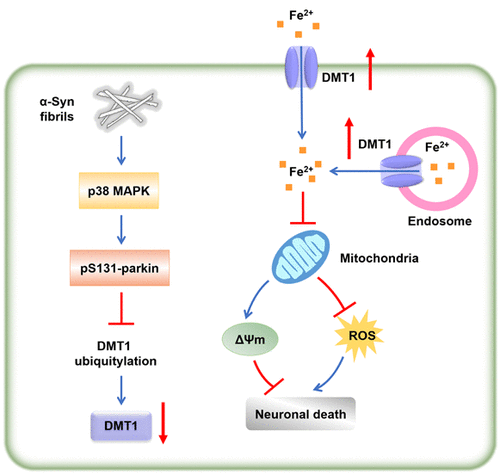
Iron metabolism imbalance plays a key role in the neurodegeneration of Parkinson’s disease (PD), thus iron homeostasis should be tightly controlled by iron transporters. α-Synuclein (α-Syn) serves as a ferrireductase and iron-binding protein, which is supposed to be linked with iron metabolism, but little is known about how α-Syn affects iron homeostasis in PD. Our previous findings that up-regulation of divalent metal transporter 1 (DMT1) accounted for the nigral iron accumulation in PD raised the question whether α-Syn disturbed iron homeostasis by modulating DMT1 expression. Using α-Syn overexpressed SH-SY5Y cells and mutant human A53T α-Syn transgenic mice, we found that α-Syn could up-regulate DMT1 protein levels, followed by enhanced ferrous iron influx and subsequent aggravated oxidative stress injury. Mechanistic studies identified that α-Syn-induced p38 mitogen-activated protein kinase (MAPK) activation phosphorylated parkin at Ser131, which inactivated parkin’s E3 ubiquitin ligase activity and further reduced DMT1 ubiquitylation level. Our findings revealed that α-Syn affected brain iron homeostasis through modulating DMT1 protein stability and altering cellular iron uptake, which might provide direct evidence for the involvement of α-Syn in iron metabolism dysfunction and provide insight into PD-associated nigral iron deposition.
中文翻译:

α-突触核蛋白通过预防帕金森病模型中的 Parkin 介导的 DMT1 泛素化来调节铁稳态。
铁代谢失衡在帕金森病 (PD) 的神经退行性变中起关键作用,因此铁稳态应由铁转运蛋白严格控制。α-突触核蛋白 (α-Syn) 作为铁还原酶和铁结合蛋白,被认为与铁代谢有关,但对于 α-Syn 如何影响 PD 中的铁稳态知之甚少。我们之前的研究结果表明,二价金属转运蛋白 1 (DMT1) 的上调是 PD 中黑质铁积累的原因,这引发了 α-Syn 是否通过调节 DMT1 表达干扰铁稳态的问题。使用 α-Syn 过表达的 SH-SY5Y 细胞和突变的人 A53T α-Syn 转基因小鼠,我们发现 α-Syn 可以上调 DMT1 蛋白水平,随后增加亚铁流入和随后加重的氧化应激损伤。机理研究发现,α-Syn 诱导的 p38 丝裂原活化蛋白激酶 (MAPK) 激活在 Ser131 位点磷酸化 parkin,从而使 parkin 的 E3 泛素连接酶活性失活并进一步降低 DMT1 泛素化水平。我们的研究结果表明,α-Syn 通过调节 DMT1 蛋白稳定性和改变细胞铁摄取来影响脑铁稳态,这可能为 α-Syn 参与铁代谢功能障碍提供直接证据,并提供对 PD 相关黑质铁沉积的深入了解。
更新日期:2020-05-07
中文翻译:

α-突触核蛋白通过预防帕金森病模型中的 Parkin 介导的 DMT1 泛素化来调节铁稳态。
铁代谢失衡在帕金森病 (PD) 的神经退行性变中起关键作用,因此铁稳态应由铁转运蛋白严格控制。α-突触核蛋白 (α-Syn) 作为铁还原酶和铁结合蛋白,被认为与铁代谢有关,但对于 α-Syn 如何影响 PD 中的铁稳态知之甚少。我们之前的研究结果表明,二价金属转运蛋白 1 (DMT1) 的上调是 PD 中黑质铁积累的原因,这引发了 α-Syn 是否通过调节 DMT1 表达干扰铁稳态的问题。使用 α-Syn 过表达的 SH-SY5Y 细胞和突变的人 A53T α-Syn 转基因小鼠,我们发现 α-Syn 可以上调 DMT1 蛋白水平,随后增加亚铁流入和随后加重的氧化应激损伤。机理研究发现,α-Syn 诱导的 p38 丝裂原活化蛋白激酶 (MAPK) 激活在 Ser131 位点磷酸化 parkin,从而使 parkin 的 E3 泛素连接酶活性失活并进一步降低 DMT1 泛素化水平。我们的研究结果表明,α-Syn 通过调节 DMT1 蛋白稳定性和改变细胞铁摄取来影响脑铁稳态,这可能为 α-Syn 参与铁代谢功能障碍提供直接证据,并提供对 PD 相关黑质铁沉积的深入了解。






























 京公网安备 11010802027423号
京公网安备 11010802027423号