当前位置:
X-MOL 学术
›
Biomaterials
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Targeting self-assembly peptide for inhibiting breast tumor progression and metastasis.
Biomaterials ( IF 12.8 ) Pub Date : 2020-04-15 , DOI: 10.1016/j.biomaterials.2020.120055 Shi Luo 1 , Jiaxing Feng 1 , Linyu Xiao 1 , Ling Guo 2 , Lang Deng 1 , Zhengwu Du 1 , Yuan Xue 1 , Xu Song 1 , Xun Sun 1 , Zhirong Zhang 1 , Yao Fu 1 , Tao Gong 1
Biomaterials ( IF 12.8 ) Pub Date : 2020-04-15 , DOI: 10.1016/j.biomaterials.2020.120055 Shi Luo 1 , Jiaxing Feng 1 , Linyu Xiao 1 , Ling Guo 2 , Lang Deng 1 , Zhengwu Du 1 , Yuan Xue 1 , Xu Song 1 , Xun Sun 1 , Zhirong Zhang 1 , Yao Fu 1 , Tao Gong 1
Affiliation
|
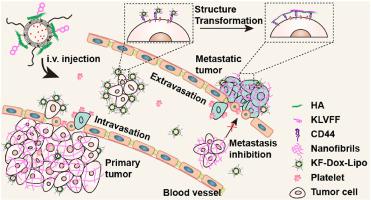
The ubiquitous interactions between tumor cells and the surrounding microenvironment contribute to tumor metastasis, interrupting these communications has, therefore, a great potential for antimetastasis therapy. Here, we describe an in situ self-assembly strategy that limits direct contact between tumor cells and the tumor microenvironment (TME). In this strategy, the Lys-Leu-Val-Phe-Phe (KLVFF) peptide motifs are targeted to the tumor by hyaluronic acid (HA) functionalized liposomes and spontaneously undergo self-assembly to form nanofibers with a net-like structure wrapping around tumor cells. The fibrous nanostructures bury the membrane protrusions and thus hinder the migration and invasion of tumor cells, especially the transmigration through the fenestrated endothelium. The nanofibril coatings on tumor cells significantly block tumor cells induced platelet aggregation in vitro and prevent the adhesion of platelet around circulating tumor cells (CTCs) in vivo, thus limit the pro-metastasis effect of platelets and prevent the early metastasis. Furthermore, the nano-nets stably retain in the primary tumor site for over 72 h and effectively prevent the activation of intratumoral platelet, which suppress tumor progression and the spontaneous lung metastasis in 4T1 breast cancer mice model. Our study paves a promising avenue to combat tumor metastasis by regulating the interactions between tumor cells and the TME.
中文翻译:

靶向自组装肽可抑制乳腺肿瘤的进展和转移。
肿瘤细胞与周围微环境之间无处不在的相互作用促进了肿瘤转移,因此中断这些交流具有抗转移治疗的巨大潜力。在这里,我们描述了一种原位自组装策略,该策略限制了肿瘤细胞与肿瘤微环境(TME)之间的直接接触。在这种策略中,Lys-Leu-Val-Phe-Phe(KLVFF)肽基序通过透明质酸(HA)功能化的脂质体靶向肿瘤,并自发自组装以形成具有围绕肿瘤包裹的网状结构的纳米纤维细胞。纤维状的纳米结构掩盖了膜的突起,因此阻碍了肿瘤细胞的迁移和侵袭,特别是穿过有窗孔的内皮的迁移。肿瘤细胞上的纳米原纤维涂层在体外显着阻断肿瘤细胞诱导的血小板凝集,并在体内阻止血小板粘附在循环肿瘤细胞(CTC)周围,从而限制了血小板的促转移作用并防止了早期转移。此外,纳米网稳定地保留在原发肿瘤部位超过72小时,并有效地阻止了肿瘤内血小板的活化,从而抑制了4T1乳腺癌小鼠模型中的肿瘤进展和自发性肺转移。我们的研究通过调节肿瘤细胞与TME之间的相互作用,为抗击肿瘤转移铺平了道路。此外,纳米网稳定地保留在原发肿瘤部位超过72小时,并有效地阻止了肿瘤内血小板的活化,从而抑制了4T1乳腺癌小鼠模型中的肿瘤进展和自发性肺转移。我们的研究通过调节肿瘤细胞与TME之间的相互作用,为抗击肿瘤转移铺平了道路。此外,纳米网稳定地保留在原发肿瘤部位超过72小时,并有效地阻止了肿瘤内血小板的活化,从而抑制了4T1乳腺癌小鼠模型中的肿瘤进展和自发性肺转移。我们的研究通过调节肿瘤细胞与TME之间的相互作用,为抗击肿瘤转移铺平了道路。
更新日期:2020-04-20
中文翻译:

靶向自组装肽可抑制乳腺肿瘤的进展和转移。
肿瘤细胞与周围微环境之间无处不在的相互作用促进了肿瘤转移,因此中断这些交流具有抗转移治疗的巨大潜力。在这里,我们描述了一种原位自组装策略,该策略限制了肿瘤细胞与肿瘤微环境(TME)之间的直接接触。在这种策略中,Lys-Leu-Val-Phe-Phe(KLVFF)肽基序通过透明质酸(HA)功能化的脂质体靶向肿瘤,并自发自组装以形成具有围绕肿瘤包裹的网状结构的纳米纤维细胞。纤维状的纳米结构掩盖了膜的突起,因此阻碍了肿瘤细胞的迁移和侵袭,特别是穿过有窗孔的内皮的迁移。肿瘤细胞上的纳米原纤维涂层在体外显着阻断肿瘤细胞诱导的血小板凝集,并在体内阻止血小板粘附在循环肿瘤细胞(CTC)周围,从而限制了血小板的促转移作用并防止了早期转移。此外,纳米网稳定地保留在原发肿瘤部位超过72小时,并有效地阻止了肿瘤内血小板的活化,从而抑制了4T1乳腺癌小鼠模型中的肿瘤进展和自发性肺转移。我们的研究通过调节肿瘤细胞与TME之间的相互作用,为抗击肿瘤转移铺平了道路。此外,纳米网稳定地保留在原发肿瘤部位超过72小时,并有效地阻止了肿瘤内血小板的活化,从而抑制了4T1乳腺癌小鼠模型中的肿瘤进展和自发性肺转移。我们的研究通过调节肿瘤细胞与TME之间的相互作用,为抗击肿瘤转移铺平了道路。此外,纳米网稳定地保留在原发肿瘤部位超过72小时,并有效地阻止了肿瘤内血小板的活化,从而抑制了4T1乳腺癌小鼠模型中的肿瘤进展和自发性肺转移。我们的研究通过调节肿瘤细胞与TME之间的相互作用,为抗击肿瘤转移铺平了道路。































 京公网安备 11010802027423号
京公网安备 11010802027423号