当前位置:
X-MOL 学术
›
ACS Catal.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Protein Conformational Change Is Essential for Reductive Activation of Lytic Polysaccharide Monooxygenase by Cellobiose Dehydrogenase.
ACS Catalysis ( IF 11.3 ) Pub Date : 2020-03-30 , DOI: 10.1021/acscatal.0c00754 Erik Breslmayr 1, 2, 3 , Christophe V F P Laurent 2, 3 , Stefan Scheiblbrandner 2 , Anita Jerkovic 2 , Derren J Heyes 1 , Chris Oostenbrink 3 , Roland Ludwig 2 , Tobias M Hedison 1, 4 , Nigel S Scrutton 1, 4 , Daniel Kracher 1, 2
ACS Catalysis ( IF 11.3 ) Pub Date : 2020-03-30 , DOI: 10.1021/acscatal.0c00754 Erik Breslmayr 1, 2, 3 , Christophe V F P Laurent 2, 3 , Stefan Scheiblbrandner 2 , Anita Jerkovic 2 , Derren J Heyes 1 , Chris Oostenbrink 3 , Roland Ludwig 2 , Tobias M Hedison 1, 4 , Nigel S Scrutton 1, 4 , Daniel Kracher 1, 2
Affiliation
|
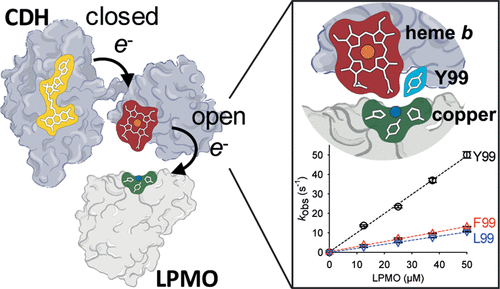
Large-scale protein domain dynamics and electron transfer are often associated. However, as protein motions span a broad range of time and length scales, it is often challenging to identify and thus link functionally relevant dynamic changes to electron transfer in proteins. It is hypothesized that large-scale domain motions direct electrons through a FAD and a heme b cofactor of the fungal cellobiose dehydrogenase (CDH) enzymes to the type-II copper center (T2Cu) of the polysaccharide-degrading lytic polysaccharide monooxygenases (LPMOs). However, as of yet, domain motions in CDH have not been linked formally to enzyme-catalyzed electron transfer reactions. The detailed structural features of CDH, which govern the functional conformational landscapes of the enzyme, have only been partially resolved. Here, we use a combination of pressure, viscosity, ionic strength, and temperature perturbation stopped-flow studies to probe the conformational landscape associated with the electron transfer reactions of CDH. Through the use of molecular dynamics simulations, potentiometry, and stopped-flow spectroscopy, we investigated how a conserved Tyr99 residue plays a key role in shaping the conformational landscapes for both the interdomain electron transfer reactions of CDH (from FAD to heme) and the delivery of electrons from the reduced heme cofactor to the LPMO T2Cu. Our studies show how motions gate the electron transfer within CDH and from CDH to LPMO and illustrate the conformational landscape for interdomain and interprotein electron transfer in this extracellular fungal electron transfer chain.
中文翻译:

蛋白质构象变化对于纤维二糖脱氢酶对裂解多糖单加氧酶的还原性激活至关重要。
大规模蛋白质域动力学和电子转移通常是相关的。然而,由于蛋白质运动跨越广泛的时间和长度尺度,因此识别功能相关的动态变化并将其与蛋白质中的电子转移联系起来通常具有挑战性。据推测,大规模域运动通过真菌纤维二糖脱氢酶 (CDH) 酶的 FAD 和血红素 b 辅因子将电子引导到多糖降解溶解性多糖单加氧酶 (LPMO) 的 II 型铜中心 (T2Cu)。然而,到目前为止,CDH 中的域运动尚未正式与酶催化的电子转移反应联系起来。CDH 的详细结构特征(控制酶的功能构象景观)仅得到部分解决。在这里,我们使用压力的组合,粘度、离子强度和温度扰动停流研究,以探索与 CDH 的电子转移反应相关的构象景观。通过使用分子动力学模拟、电位测定法和停流光谱,我们研究了保守的 Tyr99 残基如何在 CDH 的域间电子转移反应(从 FAD 到血红素)和递送的构象景观中发挥关键作用。从还原的血红素辅因子到 LPMO T2Cu 的电子。我们的研究显示了运动如何控制 CDH 内以及从 CDH 到 LPMO 的电子转移,并说明了这一细胞外真菌电子转移链中域间和蛋白质间电子转移的构象景观。和温度扰动停流研究,以探索与 CDH 的电子转移反应相关的构象景观。通过使用分子动力学模拟、电位测定法和停流光谱,我们研究了保守的 Tyr99 残基如何在 CDH 的域间电子转移反应(从 FAD 到血红素)和递送的构象景观中发挥关键作用。从还原的血红素辅因子到 LPMO T2Cu 的电子。我们的研究显示了运动如何控制 CDH 内以及从 CDH 到 LPMO 的电子转移,并说明了这一细胞外真菌电子转移链中域间和蛋白质间电子转移的构象景观。和温度扰动停流研究,以探索与 CDH 的电子转移反应相关的构象景观。通过使用分子动力学模拟、电位测定法和停流光谱,我们研究了保守的 Tyr99 残基如何在 CDH 的域间电子转移反应(从 FAD 到血红素)和递送的构象景观中发挥关键作用。从还原的血红素辅因子到 LPMO T2Cu 的电子。我们的研究显示了运动如何控制 CDH 内以及从 CDH 到 LPMO 的电子转移,并说明了这一细胞外真菌电子转移链中域间和蛋白质间电子转移的构象景观。电位测定法和停流光谱法,我们研究了保守的 Tyr99 残基如何在 CDH 的域间电子转移反应(从 FAD 到血红素)和电子从还原的血红素辅因子到LPMO T2Cu。我们的研究显示了运动如何控制 CDH 内以及从 CDH 到 LPMO 的电子转移,并说明了这一细胞外真菌电子转移链中域间和蛋白质间电子转移的构象景观。电位测定法和停流光谱法,我们研究了保守的 Tyr99 残基如何在 CDH 的域间电子转移反应(从 FAD 到血红素)和电子从还原的血红素辅因子到LPMO T2Cu。我们的研究显示了运动如何控制 CDH 内以及从 CDH 到 LPMO 的电子转移,并说明了这一细胞外真菌电子转移链中域间和蛋白质间电子转移的构象景观。
更新日期:2020-03-30
中文翻译:

蛋白质构象变化对于纤维二糖脱氢酶对裂解多糖单加氧酶的还原性激活至关重要。
大规模蛋白质域动力学和电子转移通常是相关的。然而,由于蛋白质运动跨越广泛的时间和长度尺度,因此识别功能相关的动态变化并将其与蛋白质中的电子转移联系起来通常具有挑战性。据推测,大规模域运动通过真菌纤维二糖脱氢酶 (CDH) 酶的 FAD 和血红素 b 辅因子将电子引导到多糖降解溶解性多糖单加氧酶 (LPMO) 的 II 型铜中心 (T2Cu)。然而,到目前为止,CDH 中的域运动尚未正式与酶催化的电子转移反应联系起来。CDH 的详细结构特征(控制酶的功能构象景观)仅得到部分解决。在这里,我们使用压力的组合,粘度、离子强度和温度扰动停流研究,以探索与 CDH 的电子转移反应相关的构象景观。通过使用分子动力学模拟、电位测定法和停流光谱,我们研究了保守的 Tyr99 残基如何在 CDH 的域间电子转移反应(从 FAD 到血红素)和递送的构象景观中发挥关键作用。从还原的血红素辅因子到 LPMO T2Cu 的电子。我们的研究显示了运动如何控制 CDH 内以及从 CDH 到 LPMO 的电子转移,并说明了这一细胞外真菌电子转移链中域间和蛋白质间电子转移的构象景观。和温度扰动停流研究,以探索与 CDH 的电子转移反应相关的构象景观。通过使用分子动力学模拟、电位测定法和停流光谱,我们研究了保守的 Tyr99 残基如何在 CDH 的域间电子转移反应(从 FAD 到血红素)和递送的构象景观中发挥关键作用。从还原的血红素辅因子到 LPMO T2Cu 的电子。我们的研究显示了运动如何控制 CDH 内以及从 CDH 到 LPMO 的电子转移,并说明了这一细胞外真菌电子转移链中域间和蛋白质间电子转移的构象景观。和温度扰动停流研究,以探索与 CDH 的电子转移反应相关的构象景观。通过使用分子动力学模拟、电位测定法和停流光谱,我们研究了保守的 Tyr99 残基如何在 CDH 的域间电子转移反应(从 FAD 到血红素)和递送的构象景观中发挥关键作用。从还原的血红素辅因子到 LPMO T2Cu 的电子。我们的研究显示了运动如何控制 CDH 内以及从 CDH 到 LPMO 的电子转移,并说明了这一细胞外真菌电子转移链中域间和蛋白质间电子转移的构象景观。电位测定法和停流光谱法,我们研究了保守的 Tyr99 残基如何在 CDH 的域间电子转移反应(从 FAD 到血红素)和电子从还原的血红素辅因子到LPMO T2Cu。我们的研究显示了运动如何控制 CDH 内以及从 CDH 到 LPMO 的电子转移,并说明了这一细胞外真菌电子转移链中域间和蛋白质间电子转移的构象景观。电位测定法和停流光谱法,我们研究了保守的 Tyr99 残基如何在 CDH 的域间电子转移反应(从 FAD 到血红素)和电子从还原的血红素辅因子到LPMO T2Cu。我们的研究显示了运动如何控制 CDH 内以及从 CDH 到 LPMO 的电子转移,并说明了这一细胞外真菌电子转移链中域间和蛋白质间电子转移的构象景观。































 京公网安备 11010802027423号
京公网安备 11010802027423号