Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
选择性 USP7 抑制通过 p53 依赖性机制引发癌细胞杀伤。
Scientific Reports ( IF 3.8 ) Pub Date : 2020-03-24 , DOI: 10.1038/s41598-020-62076-x Nathan J Schauer 1, 2 , Xiaoxi Liu 1, 2 , Robert S Magin 1, 2 , Laura M Doherty 1, 2, 3 , Wai Cheung Chan 1, 2 , Scott B Ficarro 1, 4, 5 , Wanyi Hu 1 , Rebekka M Roberts 1 , Roxana E Iacob 6 , Björn Stolte 7, 8, 9 , Andrew O Giacomelli 9, 10, 11 , Sumner Perera 12 , Kyle McKay 13 , Sarah A Boswell 3 , Ellen L Weisberg 10 , Arghya Ray 10, 14 , Dharminder Chauhan 10, 14 , Sirano Dhe-Paganon 1, 2 , Ken C Anderson 10, 14 , James D Griffin 10 , Jianing Li 13 , William C Hahn 9, 10, 11 , Peter K Sorger 3 , John R Engen 6 , Kimberly Stegmaier 7, 9 , Jarrod A Marto 1, 4, 5 , Sara J Buhrlage 1, 2

"点击查看英文标题和摘要"
更新日期:2020-03-24
Scientific Reports ( IF 3.8 ) Pub Date : 2020-03-24 , DOI: 10.1038/s41598-020-62076-x Nathan J Schauer 1, 2 , Xiaoxi Liu 1, 2 , Robert S Magin 1, 2 , Laura M Doherty 1, 2, 3 , Wai Cheung Chan 1, 2 , Scott B Ficarro 1, 4, 5 , Wanyi Hu 1 , Rebekka M Roberts 1 , Roxana E Iacob 6 , Björn Stolte 7, 8, 9 , Andrew O Giacomelli 9, 10, 11 , Sumner Perera 12 , Kyle McKay 13 , Sarah A Boswell 3 , Ellen L Weisberg 10 , Arghya Ray 10, 14 , Dharminder Chauhan 10, 14 , Sirano Dhe-Paganon 1, 2 , Ken C Anderson 10, 14 , James D Griffin 10 , Jianing Li 13 , William C Hahn 9, 10, 11 , Peter K Sorger 3 , John R Engen 6 , Kimberly Stegmaier 7, 9 , Jarrod A Marto 1, 4, 5 , Sara J Buhrlage 1, 2
Affiliation
|
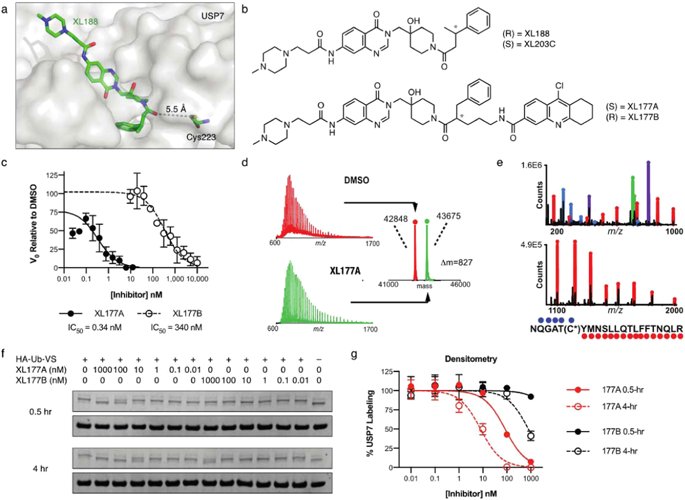
泛素特异性肽酶 7 (USP7) 是一种去泛素化酶 (DUB),可去除特定蛋白质底物的泛素标签,以改变其降解率和亚细胞定位。USP7 已被提议作为多种癌症的治疗靶点,因为它有许多已报道的在癌症进展中发挥作用的底物,包括 FOXO4、MDM2、N-Myc 和 PTEN。USP7 的多底物性质,加上早期 USP7 抑制剂的适度效力和选择性,对定义 USP7 反应的预测因子以及将从 USP7 靶向药物中受益最多的潜在患者群体提出了挑战。在这里,我们描述了 XL177A 的结构引导开发,它在人类蛋白质组中以亚 nM 的效力和选择性不可逆地抑制 USP7。对 XL177A 细胞效应的评估表明,选择性 USP7 抑制主要通过 p53 依赖性机制抑制癌细胞生长:XL177A 特异性上调 p53 转录靶标,整个转录组范围、TP53中的热点突变,但没有任何其他基因可以预测整个组对 XL177A 的反应约 500 种癌细胞系,TP53敲除可挽救 XL177A 介导的TP53野生型 (WT) 细胞的生长抑制。总之,这些发现表明TP53突变状态可作为 USP7 抑制反应的生物标志物。我们发现尤文肉瘤和恶性横纹肌样瘤 (MRT) 这两种对其他 p53 依赖性细胞毒性药物敏感的儿科癌症也表现出对 XL177A 的敏感性增加。

"点击查看英文标题和摘要"















































 京公网安备 11010802027423号
京公网安备 11010802027423号