当前位置:
X-MOL 学术
›
Chem. Eur. J.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Nanobody-Ferritin Conjugate for Targeted Photodynamic Therapy.
Chemistry - A European Journal ( IF 3.9 ) Pub Date : 2020-03-12 , DOI: 10.1002/chem.202000075 Manman Liu 1 , Yang Zhu 1 , Tiantian Wu 1 , Junjie Cheng 1 , Yangzhong Liu 1
Chemistry - A European Journal ( IF 3.9 ) Pub Date : 2020-03-12 , DOI: 10.1002/chem.202000075 Manman Liu 1 , Yang Zhu 1 , Tiantian Wu 1 , Junjie Cheng 1 , Yangzhong Liu 1
Affiliation
|
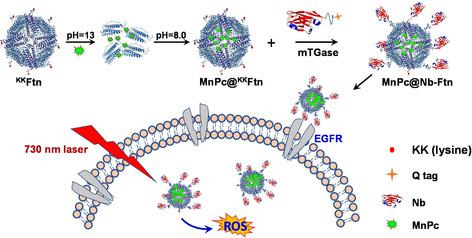
Ferritin is an iron‐storage protein nanocage that is assembled from 24 subunits. The hollow cavity of ferritin enables its encapsulation of various therapeutic agents; therefore, ferritin has been intensively investigated for drug delivery. The use of antibody‐ferritin conjugates provides an effective approach for targeted drug delivery. However, the complicated preparation and limited protein stability hamper wide applications of this system. Herein, we designed a novel nanobody‐ferritin platform (Nb‐Ftn) for targeted drug delivery. The site‐specific conjugation between nanobody and ferritin is achieved by transglutaminase‐catalyzed protein ligation. This ligation strategy allows the Nb conjugation after drug loading in ferritin, which avoids deactivation of the nanobody under the harsh pH environment required for drug encapsulation. To verify the tumor targeting of this Nb‐Ftn platform, a photodynamic reagent, manganese phthalocyanine (MnPc), was loaded into the ferritin cavity, and an anti‐EGFR nanobody was conjugated to the surface of the ferritin. The ferritin nanocage can encapsulate about 82 MnPc molecules. This MnPc@Nb‐Ftn conjugate can be efficiently internalized by EGFR positive A431 cancer cells, but not by EGFR negative MCF‐7 cells. Upon 730 nm laser irradiation, MnPc@Nb‐Ftn selectively killed EGFR positive A431 cells by generating reactive oxygen species (ROS), whereas no obvious damage was observed on MCF‐7 cells. Given that ferritin can be used for encapsulation of various therapeutic agents, this work provides a strategy for facile construction of nanobody‐ferritin for targeted drug delivery.
中文翻译:

纳米抗体-铁蛋白结合物用于靶向光动力疗法。
铁蛋白是一种铁存储蛋白纳米笼,由24个亚基组成。铁蛋白的空心腔使其能够包封各种治疗剂。因此,已经对铁蛋白的药物递送进行了深入研究。抗体-铁蛋白结合物的使用为靶向药物递送提供了有效的方法。然而,复杂的制备和有限的蛋白质稳定性阻碍了该系统的广泛应用。在此,我们设计了一种新型的纳米铁蛋白平台(Nb-Ftn)用于靶向药物递送。纳米抗体和铁蛋白之间的位点特异性偶联是通过转谷氨酰胺酶催化的蛋白连接来实现的。这种连接策略允许在铁蛋白中加载药物后进行Nb偶联,从而避免了纳米级抗体在药物封装所需的苛刻pH环境下失活。为了验证该Nb-Ftn平台的肿瘤靶向性,将一种光动力学试剂锰酞菁(MnPc)装入铁蛋白腔中,并将抗EGFR纳米抗体偶联到铁蛋白表面。铁蛋白纳米笼可封装约82个MnPc分子。EGFR阳性A431癌细胞可以有效地内化这种MnPc @ Nb-Ftn缀合物,而EGFR阴性MCF-7细胞则不能有效地使其内在化。在730 nm激光照射下,MnPc @ Nb-Ftn通过产生活性氧(ROS)选择性杀死EGFR阳性A431细胞,而在MCF-7细胞上未观察到明显的损伤。鉴于铁蛋白可用于封装各种治疗剂,这项工作为轻松构建用于靶向药物递送的纳米抗体-铁蛋白提供了一种策略。将锰酞菁(MnPc)装入铁蛋白腔中,然后将抗EGFR纳米抗体偶联至铁蛋白表面。铁蛋白纳米笼可封装约82个MnPc分子。EGFR阳性A431癌细胞可以有效地内化这种MnPc @ Nb-Ftn偶联物,而EGFR阴性MCF-7细胞不能有效地内化。在730 nm激光照射下,MnPc @ Nb-Ftn通过产生活性氧(ROS)选择性杀死EGFR阳性A431细胞,而在MCF-7细胞上未观察到明显的损伤。鉴于铁蛋白可用于封装各种治疗剂,这项工作为轻松构建用于靶向药物递送的纳米抗体-铁蛋白提供了一种策略。将锰酞菁(MnPc)装入铁蛋白腔中,然后将抗EGFR纳米抗体偶联到铁蛋白表面。铁蛋白纳米笼可封装约82个MnPc分子。EGFR阳性A431癌细胞可以有效地内化这种MnPc @ Nb-Ftn缀合物,而EGFR阴性MCF-7细胞则不能有效地使其内在化。在730 nm激光照射下,MnPc @ Nb-Ftn通过产生活性氧(ROS)选择性杀死EGFR阳性A431细胞,而在MCF-7细胞上未观察到明显的损伤。鉴于铁蛋白可用于封装各种治疗剂,这项工作为轻松构建用于靶向药物递送的纳米抗体-铁蛋白提供了一种策略。铁蛋白纳米笼可封装约82个MnPc分子。EGFR阳性A431癌细胞可以有效地内化这种MnPc @ Nb-Ftn缀合物,而EGFR阴性MCF-7细胞则不能有效地使其内在化。在730 nm激光照射下,MnPc @ Nb-Ftn通过产生活性氧(ROS)选择性杀死EGFR阳性A431细胞,而在MCF-7细胞上未观察到明显的损伤。鉴于铁蛋白可用于封装各种治疗剂,这项工作为轻松构建用于靶向药物递送的纳米抗体-铁蛋白提供了一种策略。铁蛋白纳米笼可封装约82个MnPc分子。EGFR阳性A431癌细胞可以有效地内化这种MnPc @ Nb-Ftn缀合物,而EGFR阴性MCF-7细胞则不能有效地使其内在化。在730 nm激光照射下,MnPc @ Nb-Ftn通过产生活性氧(ROS)选择性杀死EGFR阳性A431细胞,而在MCF-7细胞上未观察到明显的损伤。鉴于铁蛋白可用于封装各种治疗剂,这项工作为轻松构建用于靶向药物递送的纳米抗体-铁蛋白提供了一种策略。MnPc @ Nb-Ftn通过产生活性氧(ROS)选择性杀死EGFR阳性A431细胞,而在MCF-7细胞上未观察到明显的损伤。鉴于铁蛋白可用于封装各种治疗剂,这项工作为轻松构建用于靶向药物递送的纳米抗体-铁蛋白提供了一种策略。MnPc @ Nb-Ftn通过产生活性氧(ROS)选择性杀死EGFR阳性A431细胞,而在MCF-7细胞上未观察到明显的损伤。鉴于铁蛋白可用于封装各种治疗剂,这项工作为轻松构建用于靶向药物递送的纳米抗体-铁蛋白提供了一种策略。
更新日期:2020-03-12
中文翻译:

纳米抗体-铁蛋白结合物用于靶向光动力疗法。
铁蛋白是一种铁存储蛋白纳米笼,由24个亚基组成。铁蛋白的空心腔使其能够包封各种治疗剂。因此,已经对铁蛋白的药物递送进行了深入研究。抗体-铁蛋白结合物的使用为靶向药物递送提供了有效的方法。然而,复杂的制备和有限的蛋白质稳定性阻碍了该系统的广泛应用。在此,我们设计了一种新型的纳米铁蛋白平台(Nb-Ftn)用于靶向药物递送。纳米抗体和铁蛋白之间的位点特异性偶联是通过转谷氨酰胺酶催化的蛋白连接来实现的。这种连接策略允许在铁蛋白中加载药物后进行Nb偶联,从而避免了纳米级抗体在药物封装所需的苛刻pH环境下失活。为了验证该Nb-Ftn平台的肿瘤靶向性,将一种光动力学试剂锰酞菁(MnPc)装入铁蛋白腔中,并将抗EGFR纳米抗体偶联到铁蛋白表面。铁蛋白纳米笼可封装约82个MnPc分子。EGFR阳性A431癌细胞可以有效地内化这种MnPc @ Nb-Ftn缀合物,而EGFR阴性MCF-7细胞则不能有效地使其内在化。在730 nm激光照射下,MnPc @ Nb-Ftn通过产生活性氧(ROS)选择性杀死EGFR阳性A431细胞,而在MCF-7细胞上未观察到明显的损伤。鉴于铁蛋白可用于封装各种治疗剂,这项工作为轻松构建用于靶向药物递送的纳米抗体-铁蛋白提供了一种策略。将锰酞菁(MnPc)装入铁蛋白腔中,然后将抗EGFR纳米抗体偶联至铁蛋白表面。铁蛋白纳米笼可封装约82个MnPc分子。EGFR阳性A431癌细胞可以有效地内化这种MnPc @ Nb-Ftn偶联物,而EGFR阴性MCF-7细胞不能有效地内化。在730 nm激光照射下,MnPc @ Nb-Ftn通过产生活性氧(ROS)选择性杀死EGFR阳性A431细胞,而在MCF-7细胞上未观察到明显的损伤。鉴于铁蛋白可用于封装各种治疗剂,这项工作为轻松构建用于靶向药物递送的纳米抗体-铁蛋白提供了一种策略。将锰酞菁(MnPc)装入铁蛋白腔中,然后将抗EGFR纳米抗体偶联到铁蛋白表面。铁蛋白纳米笼可封装约82个MnPc分子。EGFR阳性A431癌细胞可以有效地内化这种MnPc @ Nb-Ftn缀合物,而EGFR阴性MCF-7细胞则不能有效地使其内在化。在730 nm激光照射下,MnPc @ Nb-Ftn通过产生活性氧(ROS)选择性杀死EGFR阳性A431细胞,而在MCF-7细胞上未观察到明显的损伤。鉴于铁蛋白可用于封装各种治疗剂,这项工作为轻松构建用于靶向药物递送的纳米抗体-铁蛋白提供了一种策略。铁蛋白纳米笼可封装约82个MnPc分子。EGFR阳性A431癌细胞可以有效地内化这种MnPc @ Nb-Ftn缀合物,而EGFR阴性MCF-7细胞则不能有效地使其内在化。在730 nm激光照射下,MnPc @ Nb-Ftn通过产生活性氧(ROS)选择性杀死EGFR阳性A431细胞,而在MCF-7细胞上未观察到明显的损伤。鉴于铁蛋白可用于封装各种治疗剂,这项工作为轻松构建用于靶向药物递送的纳米抗体-铁蛋白提供了一种策略。铁蛋白纳米笼可封装约82个MnPc分子。EGFR阳性A431癌细胞可以有效地内化这种MnPc @ Nb-Ftn缀合物,而EGFR阴性MCF-7细胞则不能有效地使其内在化。在730 nm激光照射下,MnPc @ Nb-Ftn通过产生活性氧(ROS)选择性杀死EGFR阳性A431细胞,而在MCF-7细胞上未观察到明显的损伤。鉴于铁蛋白可用于封装各种治疗剂,这项工作为轻松构建用于靶向药物递送的纳米抗体-铁蛋白提供了一种策略。MnPc @ Nb-Ftn通过产生活性氧(ROS)选择性杀死EGFR阳性A431细胞,而在MCF-7细胞上未观察到明显的损伤。鉴于铁蛋白可用于封装各种治疗剂,这项工作为轻松构建用于靶向药物递送的纳米抗体-铁蛋白提供了一种策略。MnPc @ Nb-Ftn通过产生活性氧(ROS)选择性杀死EGFR阳性A431细胞,而在MCF-7细胞上未观察到明显的损伤。鉴于铁蛋白可用于封装各种治疗剂,这项工作为轻松构建用于靶向药物递送的纳米抗体-铁蛋白提供了一种策略。































 京公网安备 11010802027423号
京公网安备 11010802027423号