Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Amphiphilic irinotecan–melampomagnolide B conjugate nanoparticles for cancer chemotherapy
RSC Advances ( IF 3.9 ) Pub Date : 2020-3-2 , DOI: 10.1039/d0ra00912a Wenhao Qu 1 , Quanjun Yang 2 , Guanchun Wang 1 , Zhaohong Wang 1 , Ping Huang 1, 3 , Wei Huang 1 , Rong Zhang 3 , Deyue Yan 1
RSC Advances ( IF 3.9 ) Pub Date : 2020-3-2 , DOI: 10.1039/d0ra00912a Wenhao Qu 1 , Quanjun Yang 2 , Guanchun Wang 1 , Zhaohong Wang 1 , Ping Huang 1, 3 , Wei Huang 1 , Rong Zhang 3 , Deyue Yan 1
Affiliation
|
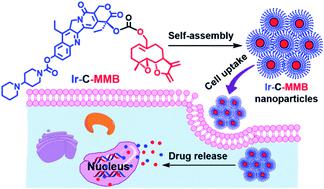
Melampomagnolide B (MMB) is a natural sesquiterpene lactone product structurally related to parthenolide (PTL). Although MMB has been widely used to treat various types of cancers, such as glioma, leukemia and colon cancer, the effective delivery of MMB to cancer cells remains a challenge. An amphiphilic drug–drug conjugate (ADDC) strategy has been proposed and developed as a promising drug self-delivery system for cancer therapy because of its simple preparation, carrier-free nature, and high therapeutic activity. Herein, we present a new ADDC, which is synthesized by linking the hydrophilic anticancer drug irinotecan (Ir) and the hydrophobic anticancer drug MMB through a carbonate bond. The obtained amphiphilic irinotecan–melampomagnolide B conjugate (Ir–C–MMB) can self-assemble in water into stable nanoparticles with an average diameter of around 122.1 nm. After cellular uptake, the carbonate bond between the hydrophilic drug and hydrophobic drug can be cleaved to release free Ir and MMB under acidic conditions, which exhibit a synergistic effect in tumor cells. MTT results reveal that the Ir–C–MMB nanoparticles can effectively inhibit proliferation of cancer cells. The apoptosis data indicate that the apoptosis rate of cells treated with Ir–C–MMB nanoparticles is about 50% within 24 h, which is much higher than that of free Ir or MMB. Our results suggest that this ADDC strategy could be used as a drug delivery platform for MMB and its derivatives, and that it offers effective synergistic therapeutic efficacy.
中文翻译:

用于癌症化疗的两亲性伊立替康-美兰博内酯 B 共轭纳米粒子
Melampomagnolide B (MMB) 是一种天然倍半萜内酯产品,结构上与小白菊内酯 (PTL) 相关。尽管 MMB 已被广泛用于治疗各种类型的癌症,例如神经胶质瘤、白血病和结肠癌,但将 MMB 有效递送至癌细胞仍然是一个挑战。由于制备简单、无载体性质和高治疗活性,两亲性药物-药物偶联物 (ADDC) 策略已被提出并开发为一种有前景的癌症治疗药物自递送系统。在此,我们提出了一种新的 ADDC,它是通过将亲水性抗癌药物伊立替康 (Ir) 和疏水性抗癌药物 MMB 通过碳酸酯键连接而合成的。获得的两亲性伊立替康-美兰泊内酯 B 共轭物 (Ir-C-MMB) 可以在水中自组装成平均直径约为 122.1 nm 的稳定纳米颗粒。细胞摄取后,亲水性药物和疏水性药物之间的碳酸酯键在酸性条件下可裂解释放出游离的Ir和MMB,在肿瘤细胞中表现出协同作用。MTT结果表明,Ir-C-MMB纳米粒子可以有效抑制癌细胞的增殖。细胞凋亡数据表明,用 Ir-C-MMB 纳米颗粒处理的细胞在 24 小时内的细胞凋亡率约为 50%,远高于游离 Ir 或 MMB。我们的研究结果表明,这种 ADDC 策略可用作 MMB 及其衍生物的药物递送平台,并提供有效的协同治疗效果。细胞摄取后,亲水性药物和疏水性药物之间的碳酸酯键在酸性条件下可裂解释放出游离的Ir和MMB,在肿瘤细胞中表现出协同作用。MTT结果表明,Ir-C-MMB纳米粒子可以有效抑制癌细胞的增殖。细胞凋亡数据表明,用 Ir-C-MMB 纳米颗粒处理的细胞在 24 小时内的细胞凋亡率约为 50%,远高于游离 Ir 或 MMB。我们的研究结果表明,这种 ADDC 策略可用作 MMB 及其衍生物的药物递送平台,并提供有效的协同治疗效果。细胞摄取后,亲水性药物和疏水性药物之间的碳酸酯键在酸性条件下可裂解释放出游离的Ir和MMB,在肿瘤细胞中表现出协同作用。MTT结果表明,Ir-C-MMB纳米粒子可以有效抑制癌细胞的增殖。细胞凋亡数据表明,用 Ir-C-MMB 纳米颗粒处理的细胞在 24 小时内的细胞凋亡率约为 50%,远高于游离 Ir 或 MMB。我们的研究结果表明,这种 ADDC 策略可用作 MMB 及其衍生物的药物递送平台,并提供有效的协同治疗效果。在肿瘤细胞中表现出协同作用。MTT结果表明,Ir-C-MMB纳米粒子可以有效抑制癌细胞的增殖。细胞凋亡数据表明,用 Ir-C-MMB 纳米颗粒处理的细胞在 24 小时内的细胞凋亡率约为 50%,远高于游离 Ir 或 MMB。我们的研究结果表明,这种 ADDC 策略可用作 MMB 及其衍生物的药物递送平台,并提供有效的协同治疗效果。在肿瘤细胞中表现出协同作用。MTT结果表明,Ir-C-MMB纳米粒子可以有效抑制癌细胞的增殖。细胞凋亡数据表明,用 Ir-C-MMB 纳米颗粒处理的细胞在 24 小时内的细胞凋亡率约为 50%,远高于游离 Ir 或 MMB。我们的研究结果表明,这种 ADDC 策略可用作 MMB 及其衍生物的药物递送平台,并提供有效的协同治疗效果。
更新日期:2020-03-02
中文翻译:

用于癌症化疗的两亲性伊立替康-美兰博内酯 B 共轭纳米粒子
Melampomagnolide B (MMB) 是一种天然倍半萜内酯产品,结构上与小白菊内酯 (PTL) 相关。尽管 MMB 已被广泛用于治疗各种类型的癌症,例如神经胶质瘤、白血病和结肠癌,但将 MMB 有效递送至癌细胞仍然是一个挑战。由于制备简单、无载体性质和高治疗活性,两亲性药物-药物偶联物 (ADDC) 策略已被提出并开发为一种有前景的癌症治疗药物自递送系统。在此,我们提出了一种新的 ADDC,它是通过将亲水性抗癌药物伊立替康 (Ir) 和疏水性抗癌药物 MMB 通过碳酸酯键连接而合成的。获得的两亲性伊立替康-美兰泊内酯 B 共轭物 (Ir-C-MMB) 可以在水中自组装成平均直径约为 122.1 nm 的稳定纳米颗粒。细胞摄取后,亲水性药物和疏水性药物之间的碳酸酯键在酸性条件下可裂解释放出游离的Ir和MMB,在肿瘤细胞中表现出协同作用。MTT结果表明,Ir-C-MMB纳米粒子可以有效抑制癌细胞的增殖。细胞凋亡数据表明,用 Ir-C-MMB 纳米颗粒处理的细胞在 24 小时内的细胞凋亡率约为 50%,远高于游离 Ir 或 MMB。我们的研究结果表明,这种 ADDC 策略可用作 MMB 及其衍生物的药物递送平台,并提供有效的协同治疗效果。细胞摄取后,亲水性药物和疏水性药物之间的碳酸酯键在酸性条件下可裂解释放出游离的Ir和MMB,在肿瘤细胞中表现出协同作用。MTT结果表明,Ir-C-MMB纳米粒子可以有效抑制癌细胞的增殖。细胞凋亡数据表明,用 Ir-C-MMB 纳米颗粒处理的细胞在 24 小时内的细胞凋亡率约为 50%,远高于游离 Ir 或 MMB。我们的研究结果表明,这种 ADDC 策略可用作 MMB 及其衍生物的药物递送平台,并提供有效的协同治疗效果。细胞摄取后,亲水性药物和疏水性药物之间的碳酸酯键在酸性条件下可裂解释放出游离的Ir和MMB,在肿瘤细胞中表现出协同作用。MTT结果表明,Ir-C-MMB纳米粒子可以有效抑制癌细胞的增殖。细胞凋亡数据表明,用 Ir-C-MMB 纳米颗粒处理的细胞在 24 小时内的细胞凋亡率约为 50%,远高于游离 Ir 或 MMB。我们的研究结果表明,这种 ADDC 策略可用作 MMB 及其衍生物的药物递送平台,并提供有效的协同治疗效果。在肿瘤细胞中表现出协同作用。MTT结果表明,Ir-C-MMB纳米粒子可以有效抑制癌细胞的增殖。细胞凋亡数据表明,用 Ir-C-MMB 纳米颗粒处理的细胞在 24 小时内的细胞凋亡率约为 50%,远高于游离 Ir 或 MMB。我们的研究结果表明,这种 ADDC 策略可用作 MMB 及其衍生物的药物递送平台,并提供有效的协同治疗效果。在肿瘤细胞中表现出协同作用。MTT结果表明,Ir-C-MMB纳米粒子可以有效抑制癌细胞的增殖。细胞凋亡数据表明,用 Ir-C-MMB 纳米颗粒处理的细胞在 24 小时内的细胞凋亡率约为 50%,远高于游离 Ir 或 MMB。我们的研究结果表明,这种 ADDC 策略可用作 MMB 及其衍生物的药物递送平台,并提供有效的协同治疗效果。




















































 京公网安备 11010802027423号
京公网安备 11010802027423号