当前位置:
X-MOL 学术
›
J. Phys. Chem. Lett.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Photoactive Yellow Protein Chromophore Photo-Isomerizes around a Single Bond if the Double Bond Is Locked.
The Journal of Physical Chemistry Letters ( IF 4.8 ) Pub Date : 2020-02-28 , DOI: 10.1021/acs.jpclett.0c00060 Satu Mustalahti 1 , Dmitry Morozov 1 , Hoi Ling Luk 1 , Rajanish R Pallerla 1 , Pasi Myllyperkiö 1 , Mika Pettersson 1 , Petri M Pihko 1 , Gerrit Groenhof 1
The Journal of Physical Chemistry Letters ( IF 4.8 ) Pub Date : 2020-02-28 , DOI: 10.1021/acs.jpclett.0c00060 Satu Mustalahti 1 , Dmitry Morozov 1 , Hoi Ling Luk 1 , Rajanish R Pallerla 1 , Pasi Myllyperkiö 1 , Mika Pettersson 1 , Petri M Pihko 1 , Gerrit Groenhof 1
Affiliation
|
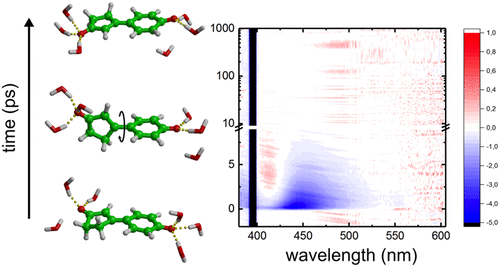
Photoactivation in the Photoactive Yellow Protein, a bacterial blue light photoreceptor, proceeds via photo-isomerization of the double C=C bond in the covalently attached chromophore. Quantum chemistry calculations, however, have suggested that in addition to double bond photo-isomerization, the isolated chromophore and many of its analogues, can isomerize around a single C-C bond as well. Whereas double bond photo-isomerization has been observed with x-ray crystallography, experimental evidence for single bond photo-isomerization is currently lacking. Therefore, we have synthesized a chromophore analogue, in which the formal double bond is covalently locked in a cyclopentenone ring and carried out transient absorption spectroscopy experiments in combination with non-adiabatic molecular dynamics simulations to reveal that the locked chromophore isomerizes around the single bond upon photo-activation. Our work thus provides experimental evidence for single bond photo-isomerization in a photoactive yellow protein chromophore analogue and suggests that photo-isomerization is not restricted to the double bonds in conjugated systems. This insight may be useful for designing light-driven molecular switches or motors.
中文翻译:

如果双键被锁定,则光敏黄色蛋白发色团在单键附近发生光异构化。
细菌蓝光感光体“光敏黄色蛋白”中的光活化是通过共价连接的生色团中双C = C键的光异构化进行的。然而,量子化学计算表明,除了双键光致异构化之外,分离的生色团及其许多类似物也可以在单个CC键周围异构化。尽管已经通过X射线晶体学观察到双键光致异构化,但是目前缺乏单键光致异构化的实验证据。因此,我们合成了发色团类似物,其中将正式双键共价键合在环戊烯酮环中,并结合非绝热分子动力学模拟进行了瞬态吸收光谱实验,揭示了光活化后,锁定的发色团围绕单键异构化。因此,我们的工作为光活性黄色蛋白发色团类似物中的单键光异构化提供了实验证据,并表明光异构化不限于共轭体系中的双键。这种见解可能对设计光驱动分子开关或电动机很有用。因此,我们的工作为光敏黄色蛋白发色团类似物中的单键光异构化提供了实验证据,并表明光异构化不限于共轭体系中的双键。这种见解可能对设计光驱动分子开关或电动机很有用。因此,我们的工作为光活性黄色蛋白发色团类似物中的单键光异构化提供了实验证据,并表明光异构化不限于共轭体系中的双键。这种见解可能对设计光驱动分子开关或电动机很有用。
更新日期:2020-03-05
中文翻译:

如果双键被锁定,则光敏黄色蛋白发色团在单键附近发生光异构化。
细菌蓝光感光体“光敏黄色蛋白”中的光活化是通过共价连接的生色团中双C = C键的光异构化进行的。然而,量子化学计算表明,除了双键光致异构化之外,分离的生色团及其许多类似物也可以在单个CC键周围异构化。尽管已经通过X射线晶体学观察到双键光致异构化,但是目前缺乏单键光致异构化的实验证据。因此,我们合成了发色团类似物,其中将正式双键共价键合在环戊烯酮环中,并结合非绝热分子动力学模拟进行了瞬态吸收光谱实验,揭示了光活化后,锁定的发色团围绕单键异构化。因此,我们的工作为光活性黄色蛋白发色团类似物中的单键光异构化提供了实验证据,并表明光异构化不限于共轭体系中的双键。这种见解可能对设计光驱动分子开关或电动机很有用。因此,我们的工作为光敏黄色蛋白发色团类似物中的单键光异构化提供了实验证据,并表明光异构化不限于共轭体系中的双键。这种见解可能对设计光驱动分子开关或电动机很有用。因此,我们的工作为光活性黄色蛋白发色团类似物中的单键光异构化提供了实验证据,并表明光异构化不限于共轭体系中的双键。这种见解可能对设计光驱动分子开关或电动机很有用。































 京公网安备 11010802027423号
京公网安备 11010802027423号