当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Water-soluble BODIPY photocages with tunable cellular localization
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2020-02-29 , DOI: 10.1021/jacs.9b13219
Dnyaneshwar Kand , Pei Liu , Marisol X Navarro , Logan J Fischer 1 , Liat Rousso-Noori , Dinorah Friedmann-Morvinski , Arthur H Winter 1 , Evan W Miller , Roy Weinstain
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2020-02-29 , DOI: 10.1021/jacs.9b13219
Dnyaneshwar Kand , Pei Liu , Marisol X Navarro , Logan J Fischer 1 , Liat Rousso-Noori , Dinorah Friedmann-Morvinski , Arthur H Winter 1 , Evan W Miller , Roy Weinstain
Affiliation
|
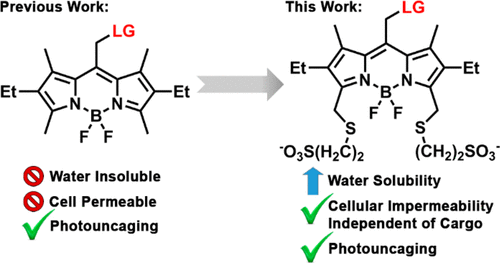
Photoactivation of bioactive molecules allows manipulation of cellular processes with high spatiotemporal precision. The recent emergence of visible-light excitable photoprotecting groups has the potential to further expand the established utility of the photoactivation strategy in biological applications by offering higher tissue penetration, diminished phototoxicity, and compatibility with other light-dependent techniques. Nevertheless, a critical barrier to such applications remains the significant hydrophobicity of most visible-light excitable photocaging groups. Here, we find that applying the conventional 2,6-sulfonation to meso-methyl BODIPY photocages is incompatible with their photoreaction due to an increase in the excited state barrier for photorelease. We present a simple, remote sulfonation solution to BODIPY photocages that imparts water solubility and provides control over cellular permeability while retaining their favorable spectroscopic and photoreaction properties. Peripherally disulfonated BODIPY photocages are cell impermeable, making them useful for modulation of cell-surface receptors, while monosulfonated BODIPY retains the ability to cross the cellular membrane and can modulate intracellular targets. This new approach is generalizable for controlling BODIPY localization and was validated by sensitization of mammalian cells and neurons by visible-light photoactivation of signaling molecules.
中文翻译:

具有可调细胞定位的水溶性 BODIPY 光笼
生物活性分子的光活化允许以高时空精度操纵细胞过程。最近出现的可见光可激发光保护基团有可能通过提供更高的组织渗透、降低的光毒性以及与其他光依赖技术的兼容性,进一步扩大光活化策略在生物应用中的既定效用。然而,此类应用的一个关键障碍仍然是大多数可见光可激发光锁闭基团的显着疏水性。在这里,我们发现将传统的 2,6-磺化应用于中甲基 BODIPY 光笼与其光反应不相容,因为光释放的激发态势垒增加。我们提出一个简单的,BODIPY 光笼的远程磺化溶液,可赋予水溶性并控制细胞渗透性,同时保留其有利的光谱和光反应特性。外周二磺化 BODIPY 光笼是细胞不可渗透的,使其可用于调节细胞表面受体,而单磺化 BODIPY 保留穿过细胞膜的能力并可以调节细胞内靶标。这种新方法可推广用于控制 BODIPY 定位,并通过信号分子的可见光光激活对哺乳动物细胞和神经元的敏化进行了验证。使它们可用于调节细胞表面受体,而单磺化 BODIPY 保留了穿过细胞膜的能力并可以调节细胞内靶标。这种新方法可推广用于控制 BODIPY 定位,并通过信号分子的可见光光激活对哺乳动物细胞和神经元的敏化进行了验证。使它们可用于调节细胞表面受体,而单磺化 BODIPY 保留了穿过细胞膜的能力并可以调节细胞内靶标。这种新方法可推广用于控制 BODIPY 定位,并通过信号分子的可见光光激活对哺乳动物细胞和神经元的敏化进行了验证。
更新日期:2020-02-29
中文翻译:

具有可调细胞定位的水溶性 BODIPY 光笼
生物活性分子的光活化允许以高时空精度操纵细胞过程。最近出现的可见光可激发光保护基团有可能通过提供更高的组织渗透、降低的光毒性以及与其他光依赖技术的兼容性,进一步扩大光活化策略在生物应用中的既定效用。然而,此类应用的一个关键障碍仍然是大多数可见光可激发光锁闭基团的显着疏水性。在这里,我们发现将传统的 2,6-磺化应用于中甲基 BODIPY 光笼与其光反应不相容,因为光释放的激发态势垒增加。我们提出一个简单的,BODIPY 光笼的远程磺化溶液,可赋予水溶性并控制细胞渗透性,同时保留其有利的光谱和光反应特性。外周二磺化 BODIPY 光笼是细胞不可渗透的,使其可用于调节细胞表面受体,而单磺化 BODIPY 保留穿过细胞膜的能力并可以调节细胞内靶标。这种新方法可推广用于控制 BODIPY 定位,并通过信号分子的可见光光激活对哺乳动物细胞和神经元的敏化进行了验证。使它们可用于调节细胞表面受体,而单磺化 BODIPY 保留了穿过细胞膜的能力并可以调节细胞内靶标。这种新方法可推广用于控制 BODIPY 定位,并通过信号分子的可见光光激活对哺乳动物细胞和神经元的敏化进行了验证。使它们可用于调节细胞表面受体,而单磺化 BODIPY 保留了穿过细胞膜的能力并可以调节细胞内靶标。这种新方法可推广用于控制 BODIPY 定位,并通过信号分子的可见光光激活对哺乳动物细胞和神经元的敏化进行了验证。































 京公网安备 11010802027423号
京公网安备 11010802027423号