当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
NMT1 and NMT2 are lysine myristoyltransferases regulating the ARF6 GTPase cycle.
Nature Communications ( IF 14.7 ) Pub Date : 2020-02-26 , DOI: 10.1038/s41467-020-14893-x Tatsiana Kosciuk 1 , Ian R Price 1 , Xiaoyu Zhang 1 , Chengliang Zhu 1 , Kayla N Johnson 1 , Shuai Zhang 1, 2 , Steve L Halaby 3 , Garrison P Komaniecki 1 , Min Yang 1 , Caroline J DeHart 4 , Paul M Thomas 4 , Neil L Kelleher 4 , J Christopher Fromme 3 , Hening Lin 1, 2
Nature Communications ( IF 14.7 ) Pub Date : 2020-02-26 , DOI: 10.1038/s41467-020-14893-x Tatsiana Kosciuk 1 , Ian R Price 1 , Xiaoyu Zhang 1 , Chengliang Zhu 1 , Kayla N Johnson 1 , Shuai Zhang 1, 2 , Steve L Halaby 3 , Garrison P Komaniecki 1 , Min Yang 1 , Caroline J DeHart 4 , Paul M Thomas 4 , Neil L Kelleher 4 , J Christopher Fromme 3 , Hening Lin 1, 2
Affiliation
|
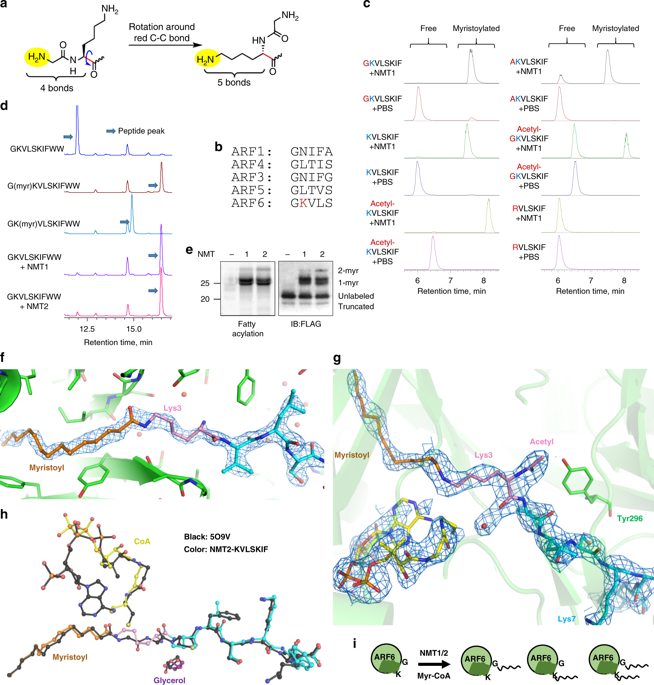
Lysine fatty acylation in mammalian cells was discovered nearly three decades ago, yet the enzymes catalyzing it remain unknown. Unexpectedly, we find that human N-terminal glycine myristoyltransferases (NMT) 1 and 2 can efficiently myristoylate specific lysine residues. They modify ADP-ribosylation factor 6 (ARF6) on lysine 3 allowing it to remain on membranes during the GTPase cycle. We demonstrate that the NAD+-dependent deacylase SIRT2 removes the myristoyl group, and our evidence suggests that NMT prefers the GTP-bound while SIRT2 prefers the GDP-bound ARF6. This allows the lysine myrisotylation-demyristoylation cycle to couple to and promote the GTPase cycle of ARF6. Our study provides an explanation for the puzzling dissimilarity of ARF6 to other ARFs and suggests the existence of other substrates regulated by this previously unknown function of NMT. Furthermore, we identified a NMT/SIRT2-ARF6 regulatory axis, which may offer new ways to treat human diseases.
中文翻译:

NMT1 和 NMT2 是调节 ARF6 GTP 酶循环的赖氨酸肉豆蔻酰转移酶。
近三十年前就发现了哺乳动物细胞中的赖氨酸脂肪酰化,但催化它的酶仍然未知。出乎意料的是,我们发现人 N 端甘氨酸肉豆蔻酰转移酶 (NMT) 1 和 2 可以有效地将特定的赖氨酸残基肉豆蔻酰化。他们修饰赖氨酸 3 上的 ADP-核糖基化因子 6 (ARF6),使其在 GTP 酶循环期间保留在膜上。我们证明 NAD+ 依赖性脱酰酶 SIRT2 可以去除肉豆蔻酰基,并且我们的证据表明 NMT 更喜欢 GTP 结合,而 SIRT2 更喜欢 GDP 结合的 ARF6。这使得赖氨酸肉豆蔻酰化-去肉豆蔻酰化循环耦合并促进ARF6的GTP酶循环。我们的研究为 ARF6 与其他 ARF 令人费解的差异提供了解释,并表明存在受 NMT 这种先前未知功能调节的其他底物。此外,我们还确定了 NMT/SIRT2-ARF6 调控轴,这可能为治疗人类疾病提供新方法。
更新日期:2020-02-26
中文翻译:

NMT1 和 NMT2 是调节 ARF6 GTP 酶循环的赖氨酸肉豆蔻酰转移酶。
近三十年前就发现了哺乳动物细胞中的赖氨酸脂肪酰化,但催化它的酶仍然未知。出乎意料的是,我们发现人 N 端甘氨酸肉豆蔻酰转移酶 (NMT) 1 和 2 可以有效地将特定的赖氨酸残基肉豆蔻酰化。他们修饰赖氨酸 3 上的 ADP-核糖基化因子 6 (ARF6),使其在 GTP 酶循环期间保留在膜上。我们证明 NAD+ 依赖性脱酰酶 SIRT2 可以去除肉豆蔻酰基,并且我们的证据表明 NMT 更喜欢 GTP 结合,而 SIRT2 更喜欢 GDP 结合的 ARF6。这使得赖氨酸肉豆蔻酰化-去肉豆蔻酰化循环耦合并促进ARF6的GTP酶循环。我们的研究为 ARF6 与其他 ARF 令人费解的差异提供了解释,并表明存在受 NMT 这种先前未知功能调节的其他底物。此外,我们还确定了 NMT/SIRT2-ARF6 调控轴,这可能为治疗人类疾病提供新方法。


















































 京公网安备 11010802027423号
京公网安备 11010802027423号