当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Structure of the human cation-chloride cotransporter NKCC1 determined by single-particle electron cryo-microscopy.
Nature Communications ( IF 14.7 ) Pub Date : 2020-02-21 , DOI: 10.1038/s41467-020-14790-3
Xiaoyong Yang 1 , Qinzhe Wang 1 , Erhu Cao 1
Nature Communications ( IF 14.7 ) Pub Date : 2020-02-21 , DOI: 10.1038/s41467-020-14790-3
Xiaoyong Yang 1 , Qinzhe Wang 1 , Erhu Cao 1
Affiliation
|
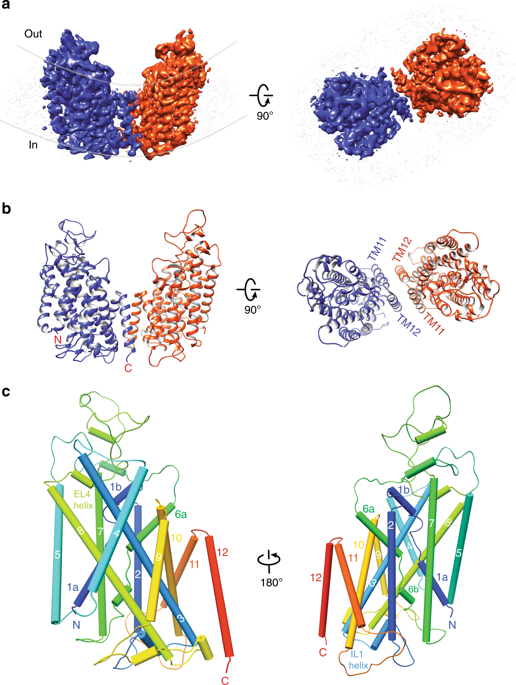
The secondary active cation-chloride cotransporters (CCCs) utilize the existing Na+ and/or K+ gradients to move Cl- into or out of cells. NKCC1 is an intensively studied member of the CCC family and plays fundamental roles in regulating trans-epithelial ion movement, cell volume, chloride homeostasis and neuronal excitability. Here, we report a cryo-EM structure of human NKCC1 captured in a partially loaded, inward-open state. NKCC1 assembles into a dimer, with the first ten transmembrane (TM) helices harboring the transport core and TM11-TM12 helices lining the dimer interface. TM1 and TM6 helices break α-helical geometry halfway across the lipid bilayer where ion binding sites are organized around these discontinuous regions. NKCC1 may harbor multiple extracellular entryways and intracellular exits, raising the possibility that K+, Na+, and Cl- ions may traverse along their own routes for translocation. NKCC1 structure provides a blueprint for further probing structure-function relationships of NKCC1 and other CCCs.
中文翻译:

通过单粒子电子冷冻显微镜测定人阳离子-氯离子协同转运蛋白 NKCC1 的结构。
二级活性阳离子-氯离子协同转运蛋白 (CCC) 利用现有的 Na+ 和/或 K+ 梯度将 Cl- 移入或移出细胞。 NKCC1 是 CCC 家族中经过深入研究的成员,在调节跨上皮离子运动、细胞体积、氯离子稳态和神经元兴奋性方面发挥着重要作用。在这里,我们报告了在部分加载、向内开放状态下捕获的人类 NKCC1 的冷冻电镜结构。 NKCC1 组装成二聚体,前十个跨膜 (TM) 螺旋包含转运核心,TM11-TM12 螺旋位于二聚体界面。 TM1 和 TM6 螺旋在脂质双层的中间打破了 α 螺旋几何形状,其中离子结合位点围绕这些不连续区域组织。 NKCC1 可能具有多个细胞外入口和细胞内出口,增加了 K+、Na+ 和 Cl- 离子可能沿着自己的路线进行易位的可能性。 NKCC1结构为进一步探讨NKCC1和其他CCC的结构-功能关系提供了蓝图。
更新日期:2020-02-21
中文翻译:

通过单粒子电子冷冻显微镜测定人阳离子-氯离子协同转运蛋白 NKCC1 的结构。
二级活性阳离子-氯离子协同转运蛋白 (CCC) 利用现有的 Na+ 和/或 K+ 梯度将 Cl- 移入或移出细胞。 NKCC1 是 CCC 家族中经过深入研究的成员,在调节跨上皮离子运动、细胞体积、氯离子稳态和神经元兴奋性方面发挥着重要作用。在这里,我们报告了在部分加载、向内开放状态下捕获的人类 NKCC1 的冷冻电镜结构。 NKCC1 组装成二聚体,前十个跨膜 (TM) 螺旋包含转运核心,TM11-TM12 螺旋位于二聚体界面。 TM1 和 TM6 螺旋在脂质双层的中间打破了 α 螺旋几何形状,其中离子结合位点围绕这些不连续区域组织。 NKCC1 可能具有多个细胞外入口和细胞内出口,增加了 K+、Na+ 和 Cl- 离子可能沿着自己的路线进行易位的可能性。 NKCC1结构为进一步探讨NKCC1和其他CCC的结构-功能关系提供了蓝图。

































 京公网安备 11010802027423号
京公网安备 11010802027423号