当前位置:
X-MOL 学术
›
JAMA Oncol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Effect of Pembrolizumab Plus Neoadjuvant Chemotherapy on Pathologic Complete Response in Women With Early-Stage Breast Cancer: An Analysis of the Ongoing Phase 2 Adaptively Randomized I-SPY2 Trial.
JAMA Oncology ( IF 22.5 ) Pub Date : 2020-05-01 , DOI: 10.1001/jamaoncol.2019.6650 Rita Nanda 1 , Minetta C Liu 2 , Christina Yau 3 , Rebecca Shatsky 4 , Lajos Pusztai 5 , Anne Wallace 4 , A Jo Chien 3 , Andres Forero-Torres 6 , Erin Ellis 7 , Heather Han 8 , Amy Clark 9 , Kathy Albain 10 , Judy C Boughey 2 , Nora T Jaskowiak 1 , Anthony Elias 11 , Claudine Isaacs 12 , Kathleen Kemmer 13 , Teresa Helsten 4 , Melanie Majure 3 , Erica Stringer-Reasor 6 , Catherine Parker 1 , Marie C Lee 8 , Tufia Haddad 2 , Ronald N Cohen 1 , Smita Asare 14 , Amy Wilson 14 , Gillian L Hirst 3 , Ruby Singhrao 3 , Katherine Steeg 3 , Adam Asare 14 , Jeffrey B Matthews 3 , Scott Berry 15 , Ashish Sanil 15 , Richard Schwab 4 , W Fraser Symmans 16 , Laura van 't Veer 3 , Douglas Yee 17 , Angela DeMichele 9 , Nola M Hylton 3 , Michelle Melisko 3 , Jane Perlmutter 18 , Hope S Rugo 3 , Donald A Berry 15 , Laura J Esserman 3
JAMA Oncology ( IF 22.5 ) Pub Date : 2020-05-01 , DOI: 10.1001/jamaoncol.2019.6650 Rita Nanda 1 , Minetta C Liu 2 , Christina Yau 3 , Rebecca Shatsky 4 , Lajos Pusztai 5 , Anne Wallace 4 , A Jo Chien 3 , Andres Forero-Torres 6 , Erin Ellis 7 , Heather Han 8 , Amy Clark 9 , Kathy Albain 10 , Judy C Boughey 2 , Nora T Jaskowiak 1 , Anthony Elias 11 , Claudine Isaacs 12 , Kathleen Kemmer 13 , Teresa Helsten 4 , Melanie Majure 3 , Erica Stringer-Reasor 6 , Catherine Parker 1 , Marie C Lee 8 , Tufia Haddad 2 , Ronald N Cohen 1 , Smita Asare 14 , Amy Wilson 14 , Gillian L Hirst 3 , Ruby Singhrao 3 , Katherine Steeg 3 , Adam Asare 14 , Jeffrey B Matthews 3 , Scott Berry 15 , Ashish Sanil 15 , Richard Schwab 4 , W Fraser Symmans 16 , Laura van 't Veer 3 , Douglas Yee 17 , Angela DeMichele 9 , Nola M Hylton 3 , Michelle Melisko 3 , Jane Perlmutter 18 , Hope S Rugo 3 , Donald A Berry 15 , Laura J Esserman 3
Affiliation
|
Importance
Approximately 25% of patients with early-stage breast cancer who receive (neo)adjuvant chemotherapy experience a recurrence within 5 years. Improvements in therapy are greatly needed.
Objective
To determine if pembrolizumab plus neoadjuvant chemotherapy (NACT) in early-stage breast cancer is likely to be successful in a 300-patient, confirmatory randomized phase 3 neoadjuvant clinical trial.
Design, Setting, and Participants
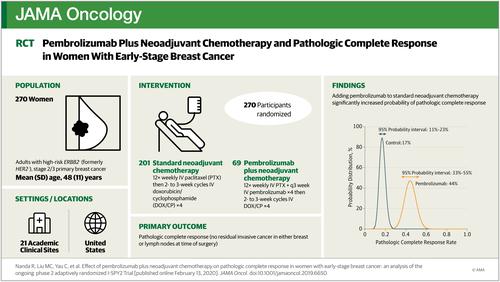
The I-SPY2 study is an ongoing open-label, multicenter, adaptively randomized phase 2 platform trial for high-risk, stage II/III breast cancer, evaluating multiple investigational arms in parallel. Standard NACT serves as the common control arm; investigational agent(s) are added to this backbone. Patients with ERBB2 (formerly HER2)-negative breast cancer were eligible for randomization to pembrolizumab between November 2015 and November 2016.
Interventions
Participants were randomized to receive taxane- and anthracycline-based NACT with or without pembrolizumab, followed by definitive surgery.
Main Outcomes and Measures
The primary end point was pathologic complete response (pCR). Secondary end points were residual cancer burden (RCB) and 3-year event-free and distant recurrence-free survival. Investigational arms graduated when demonstrating an 85% predictive probability of success in a hypothetical confirmatory phase 3 trial.
Results
Of the 250 women included in the final analysis, 181 were randomized to the standard NACT control group (median [range] age, 47 [24.77] years). Sixty-nine women (median [range] age, 50 [27-71] years) were randomized to 4 cycles of pembrolizumab in combination with weekly paclitaxel followed by AC; 40 hormone receptor (HR)-positive and 29 triple-negative. Pembrolizumab graduated in all 3 biomarker signatures studied. Final estimated pCR rates, evaluated in March 2017, were 44% vs 17%, 30% vs 13%, and 60% vs 22% for pembrolizumab vs control in the ERBB2-negative, HR-positive/ERBB2-negative, and triple-negative cohorts, respectively. Pembrolizumab shifted the RCB distribution to a lower disease burden for each cohort evaluated. Adverse events included immune-related endocrinopathies, notably thyroid abnormalities (13.0%) and adrenal insufficiency (8.7%). Achieving a pCR appeared predictive of long-term outcome, where patients with pCR following pembrolizumab plus chemotherapy had high event-free survival rates (93% at 3 years with 2.8 years' median follow-up).
Conclusions and Relevance
When added to standard neoadjuvant chemotherapy, pembrolizumab more than doubled the estimated pCR rates for both HR-positive/ERBB2-negative and triple-negative breast cancer, indicating that checkpoint blockade in women with early-stage, high-risk, ERBB2-negative breast cancer is highly likely to succeed in a phase 3 trial. Pembrolizumab was the first of 10 agents to graduate in the HR-positive/ERBB2-negative signature.
Trial Registration
ClinicalTrials.gov Identifier: NCT01042379.
中文翻译:

Pembrolizumab 加新辅助化疗对早期乳腺癌女性病理学完全缓解的影响:正在进行的 2 期适应性随机 I-SPY2 试验分析。
重要性 大约 25% 接受(新)辅助化疗的早期乳腺癌患者会在 5 年内复发。非常需要改进治疗。目的 确定帕博利珠单抗加新辅助化疗 (NACT) 在早期乳腺癌中是否可能在 300 名患者的确认性随机 3 期新辅助临床试验中取得成功。设计、设置和参与者 I-SPY2 研究是一项针对高危 II/III 期乳腺癌的开放标签、多中心、适应性随机化 2 期平台试验,同时评估多个研究组。标准 NACT 作为通用控制臂;将研究药物添加到该骨干中。ERBB2(以前称为 HER2)阴性乳腺癌患者有资格在 2015 年 11 月至 2016 年 11 月期间随机分配至帕博利珠单抗。主要成果和措施 主要终点是病理学完全反应 (pCR)。次要终点是残余癌症负担 (RCB) 和 3 年无事件和无远处复发生存期。当在假设的验证性 3 期试验中证明成功的预测概率为 85% 时,研究组毕业。结果 在最终分析中包括的 250 名女性中,181 名被随机分配到标准 NACT 对照组(中位 [范围] 年龄,47 [24.77] 岁)。69 名女性(中位 [范围] 年龄,50 [27-71] 岁)被随机分配到 4 个周期的帕博利珠单抗联合每周紫杉醇,然后接受 AC;40 例激素受体 (HR) 阳性和 29 例三阴性。Pembrolizumab 在所研究的所有 3 种生物标志物特征中都取得了进展。2017 年 3 月评估的最终估计 pCR 率在 ERBB2 阴性、HR 阳性/ERBB2 阴性和三联组中帕博利珠单抗与对照分别为 44% 对 17%、30% 对 13% 和 60% 对 22%负队列,分别。对于每个评估的队列,派姆单抗将 RCB 分布转移到较低的疾病负担。不良事件包括免疫相关的内分泌疾病,特别是甲状腺异常 (13.0%) 和肾上腺功能不全 (8.7%)。实现 pCR 似乎可以预测长期结果,其中,pembrolizumab 联合化疗后达到 pCR 的患者具有较高的无事件生存率(3 年时为 93%,中位随访时间为 2.8 年)。结论和相关性 当添加到标准新辅助化疗时,pembrolizumab 使 HR 阳性/ERBB2 阴性和三阴性乳腺癌的估计 pCR 率增加了一倍以上,表明早期、高风险、ERBB2 女性的检查点阻断阴性乳腺癌极有可能在 3 期试验中取得成功。Pembrolizumab 是 10 种以 HR 阳性/ERBB2 阴性特征毕业的药物中的第一种。试验注册 ClinicalTrials.gov 标识符:NCT01042379。pembrolizumab 使 HR 阳性/ERBB2 阴性和三阴性乳腺癌的估计 pCR 率提高了一倍以上,表明对患有早期、高风险、ERBB2 阴性乳腺癌的女性进行检查点阻断很可能成功3 期试验。Pembrolizumab 是 10 种以 HR 阳性/ERBB2 阴性特征毕业的药物中的第一种。试验注册 ClinicalTrials.gov 标识符:NCT01042379。pembrolizumab 使 HR 阳性/ERBB2 阴性和三阴性乳腺癌的估计 pCR 率提高了一倍以上,表明对患有早期、高风险、ERBB2 阴性乳腺癌的女性进行检查点阻断很可能成功3 期试验。Pembrolizumab 是 10 种以 HR 阳性/ERBB2 阴性特征毕业的药物中的第一种。试验注册 ClinicalTrials.gov 标识符:NCT01042379。
更新日期:2020-05-01
中文翻译:

Pembrolizumab 加新辅助化疗对早期乳腺癌女性病理学完全缓解的影响:正在进行的 2 期适应性随机 I-SPY2 试验分析。
重要性 大约 25% 接受(新)辅助化疗的早期乳腺癌患者会在 5 年内复发。非常需要改进治疗。目的 确定帕博利珠单抗加新辅助化疗 (NACT) 在早期乳腺癌中是否可能在 300 名患者的确认性随机 3 期新辅助临床试验中取得成功。设计、设置和参与者 I-SPY2 研究是一项针对高危 II/III 期乳腺癌的开放标签、多中心、适应性随机化 2 期平台试验,同时评估多个研究组。标准 NACT 作为通用控制臂;将研究药物添加到该骨干中。ERBB2(以前称为 HER2)阴性乳腺癌患者有资格在 2015 年 11 月至 2016 年 11 月期间随机分配至帕博利珠单抗。主要成果和措施 主要终点是病理学完全反应 (pCR)。次要终点是残余癌症负担 (RCB) 和 3 年无事件和无远处复发生存期。当在假设的验证性 3 期试验中证明成功的预测概率为 85% 时,研究组毕业。结果 在最终分析中包括的 250 名女性中,181 名被随机分配到标准 NACT 对照组(中位 [范围] 年龄,47 [24.77] 岁)。69 名女性(中位 [范围] 年龄,50 [27-71] 岁)被随机分配到 4 个周期的帕博利珠单抗联合每周紫杉醇,然后接受 AC;40 例激素受体 (HR) 阳性和 29 例三阴性。Pembrolizumab 在所研究的所有 3 种生物标志物特征中都取得了进展。2017 年 3 月评估的最终估计 pCR 率在 ERBB2 阴性、HR 阳性/ERBB2 阴性和三联组中帕博利珠单抗与对照分别为 44% 对 17%、30% 对 13% 和 60% 对 22%负队列,分别。对于每个评估的队列,派姆单抗将 RCB 分布转移到较低的疾病负担。不良事件包括免疫相关的内分泌疾病,特别是甲状腺异常 (13.0%) 和肾上腺功能不全 (8.7%)。实现 pCR 似乎可以预测长期结果,其中,pembrolizumab 联合化疗后达到 pCR 的患者具有较高的无事件生存率(3 年时为 93%,中位随访时间为 2.8 年)。结论和相关性 当添加到标准新辅助化疗时,pembrolizumab 使 HR 阳性/ERBB2 阴性和三阴性乳腺癌的估计 pCR 率增加了一倍以上,表明早期、高风险、ERBB2 女性的检查点阻断阴性乳腺癌极有可能在 3 期试验中取得成功。Pembrolizumab 是 10 种以 HR 阳性/ERBB2 阴性特征毕业的药物中的第一种。试验注册 ClinicalTrials.gov 标识符:NCT01042379。pembrolizumab 使 HR 阳性/ERBB2 阴性和三阴性乳腺癌的估计 pCR 率提高了一倍以上,表明对患有早期、高风险、ERBB2 阴性乳腺癌的女性进行检查点阻断很可能成功3 期试验。Pembrolizumab 是 10 种以 HR 阳性/ERBB2 阴性特征毕业的药物中的第一种。试验注册 ClinicalTrials.gov 标识符:NCT01042379。pembrolizumab 使 HR 阳性/ERBB2 阴性和三阴性乳腺癌的估计 pCR 率提高了一倍以上,表明对患有早期、高风险、ERBB2 阴性乳腺癌的女性进行检查点阻断很可能成功3 期试验。Pembrolizumab 是 10 种以 HR 阳性/ERBB2 阴性特征毕业的药物中的第一种。试验注册 ClinicalTrials.gov 标识符:NCT01042379。































 京公网安备 11010802027423号
京公网安备 11010802027423号