当前位置:
X-MOL 学术
›
Nano Lett.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Charge Conversional Biomimetic Nanocomplexes as a Multifunctional Platform for Boosting Orthotopic Glioblastoma RNAi Therapy.
Nano Letters ( IF 9.6 ) Pub Date : 2020-02-03 , DOI: 10.1021/acs.nanolett.9b04683
Yanjie Liu 1 , Yan Zou 1, 2 , Chan Feng 3 , Albert Lee 2 , Jinlong Yin 4 , Roger Chung 2 , Jong Bea Park 4 , Helen Rizos 2 , Wei Tao 3 , Meng Zheng 1 , Omid C Farokhzad 3 , Bingyang Shi 1, 2
Nano Letters ( IF 9.6 ) Pub Date : 2020-02-03 , DOI: 10.1021/acs.nanolett.9b04683
Yanjie Liu 1 , Yan Zou 1, 2 , Chan Feng 3 , Albert Lee 2 , Jinlong Yin 4 , Roger Chung 2 , Jong Bea Park 4 , Helen Rizos 2 , Wei Tao 3 , Meng Zheng 1 , Omid C Farokhzad 3 , Bingyang Shi 1, 2
Affiliation
|
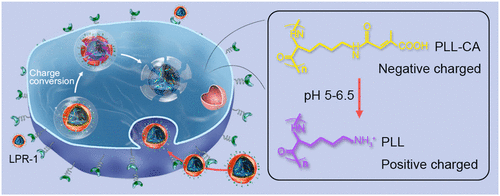
Nanotechnology-based RNA interference (RNAi) has shown great promise in overcoming the limitations of traditional clinical treatments for glioblastoma (GBM). However, because of the complexity of brain physiology, simple blood-brain barrier (BBB) penetration or tumor-targeting strategies cannot entirely meet the demanding requirements of different therapeutic delivery stages. Herein, we developed a charge conversional biomimetic nanoplatform with a three-layer core-shell structure to programmatically overcome persistent obstacles in siRNA delivery to GBM. The resulting nanocomplex presents good biocompatibility, prolonged blood circulation, high BBB transcytosis, effective tumor accumulation, and specific uptake by tumor cells in the brain. Moreover, red blood cell membrane (RBCm) disruption and effective siRNA release can be further triggered elegantly by charge conversion from negative to positive in the endo/lysosome (pH 5.0-6.5) of tumor cells, leading to highly potent target-gene silencing with a strong anti-GBM effect. Our study provides an intelligent biomimetic nanoplatform tailored for systemically siRNA delivery to GBM, leveraging Angiopep-2 peptide-modified, immune-free RBCm and charge conversional components. Improved therapeutic efficacy, higher survival rates, and minimized systemic side effects were achieved in orthotopic U87MG-luc human glioblastoma tumor-bearing nude mice.
中文翻译:

电荷转换仿生纳米复合物作为促进原位胶质母细胞瘤 RNAi 治疗的多功能平台。
基于纳米技术的 RNA 干扰 (RNAi) 在克服胶质母细胞瘤 (GBM) 传统临床治疗的局限性方面显示出巨大的希望。然而,由于脑生理学的复杂性,简单的血脑屏障(BBB)穿透或肿瘤靶向策略不能完全满足不同治疗递送阶段的苛刻要求。在此,我们开发了一种具有三层核壳结构的电荷转换仿生纳米平台,以编程方式克服将 siRNA 传递到 GBM 中的持续障碍。由此产生的纳米复合物具有良好的生物相容性、延长的血液循环、高 BBB 转胞吞作用、有效的肿瘤积累以及脑中肿瘤细胞的特异性摄取。而且,通过在肿瘤细胞的内/溶酶体(pH 5.0-6.5)中从负电荷转换为正电荷,可以进一步优雅地触发红细胞膜 (RBCm) 破坏和有效的 siRNA 释放,从而导致高效的靶基因沉默。抗 GBM 作用。我们的研究提供了一个智能仿生纳米平台,该平台利用 Angiopep-2 肽修饰的、无免疫的 RBCm 和电荷转换成分,专为将 siRNA 系统地传递到 GBM 而量身定制。在原位 U87MG-luc 人胶质母细胞瘤荷瘤裸鼠中实现了更高的治疗效果、更高的存活率和最小的全身副作用。我们的研究提供了一个智能仿生纳米平台,该平台利用 Angiopep-2 肽修饰的、无免疫的 RBCm 和电荷转换成分,专为将 siRNA 系统地传递到 GBM 而量身定制。在原位 U87MG-luc 人胶质母细胞瘤荷瘤裸鼠中实现了更高的治疗效果、更高的存活率和最小的全身副作用。我们的研究提供了一个智能仿生纳米平台,该平台利用 Angiopep-2 肽修饰的、无免疫的 RBCm 和电荷转换成分,专为将 siRNA 系统地传递到 GBM 而量身定制。在原位 U87MG-luc 人胶质母细胞瘤荷瘤裸鼠中实现了更高的治疗效果、更高的存活率和最小的全身副作用。
更新日期:2020-02-07
中文翻译:

电荷转换仿生纳米复合物作为促进原位胶质母细胞瘤 RNAi 治疗的多功能平台。
基于纳米技术的 RNA 干扰 (RNAi) 在克服胶质母细胞瘤 (GBM) 传统临床治疗的局限性方面显示出巨大的希望。然而,由于脑生理学的复杂性,简单的血脑屏障(BBB)穿透或肿瘤靶向策略不能完全满足不同治疗递送阶段的苛刻要求。在此,我们开发了一种具有三层核壳结构的电荷转换仿生纳米平台,以编程方式克服将 siRNA 传递到 GBM 中的持续障碍。由此产生的纳米复合物具有良好的生物相容性、延长的血液循环、高 BBB 转胞吞作用、有效的肿瘤积累以及脑中肿瘤细胞的特异性摄取。而且,通过在肿瘤细胞的内/溶酶体(pH 5.0-6.5)中从负电荷转换为正电荷,可以进一步优雅地触发红细胞膜 (RBCm) 破坏和有效的 siRNA 释放,从而导致高效的靶基因沉默。抗 GBM 作用。我们的研究提供了一个智能仿生纳米平台,该平台利用 Angiopep-2 肽修饰的、无免疫的 RBCm 和电荷转换成分,专为将 siRNA 系统地传递到 GBM 而量身定制。在原位 U87MG-luc 人胶质母细胞瘤荷瘤裸鼠中实现了更高的治疗效果、更高的存活率和最小的全身副作用。我们的研究提供了一个智能仿生纳米平台,该平台利用 Angiopep-2 肽修饰的、无免疫的 RBCm 和电荷转换成分,专为将 siRNA 系统地传递到 GBM 而量身定制。在原位 U87MG-luc 人胶质母细胞瘤荷瘤裸鼠中实现了更高的治疗效果、更高的存活率和最小的全身副作用。我们的研究提供了一个智能仿生纳米平台,该平台利用 Angiopep-2 肽修饰的、无免疫的 RBCm 和电荷转换成分,专为将 siRNA 系统地传递到 GBM 而量身定制。在原位 U87MG-luc 人胶质母细胞瘤荷瘤裸鼠中实现了更高的治疗效果、更高的存活率和最小的全身副作用。

































 京公网安备 11010802027423号
京公网安备 11010802027423号