当前位置:
X-MOL 学术
›
Anal. Chem.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Sensitive Label-Free Thermal Stability Assay for Protein Denaturation and Protein-Ligand Interaction Studies.
Analytical Chemistry ( IF 6.7 ) Pub Date : 2020-02-12 , DOI: 10.1021/acs.analchem.9b05712 Emmiliisa Vuorinen 1 , Salla Valtonen 1 , Ville Eskonen 1 , Taru Kariniemi 1 , Jelena Jakovleva 1 , Kari Kopra 1 , Harri Härmä 1
Analytical Chemistry ( IF 6.7 ) Pub Date : 2020-02-12 , DOI: 10.1021/acs.analchem.9b05712 Emmiliisa Vuorinen 1 , Salla Valtonen 1 , Ville Eskonen 1 , Taru Kariniemi 1 , Jelena Jakovleva 1 , Kari Kopra 1 , Harri Härmä 1
Affiliation
|
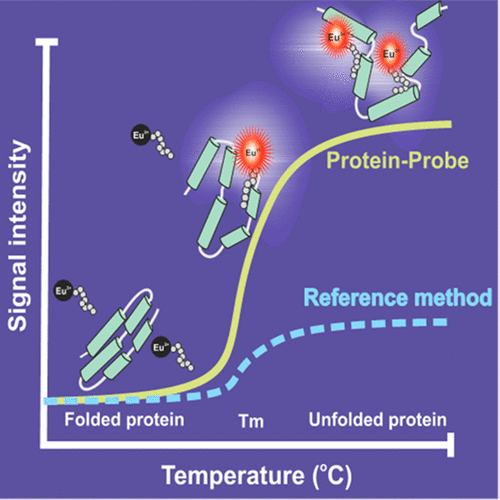
In modern biochemistry, protein stability and ligand interactions are of high interest. These properties are often studied with methods requiring labeled biomolecules, as the existing methods utilizing luminescent external probes suffer from low sensitivity. Currently available label-free technologies, e.g., thermal shift assays, circular dichroism, and differential scanning calorimetry, enable studies on protein unfolding and protein-ligand interactions (PLI). Unfortunately, the required micromolar protein concentration increases the costs and predisposes these methods for spontaneous protein aggregation. Here, we report a time-resolved luminescence method for protein unfolding and PLI detection with nanomolar sensitivity. The Protein-Probe method is based on highly luminescent europium chelate-conjugated probe, which is the key component in sensing the hydrophobic regions exposed to solution after protein unfolding. With the same Eu-probe, we also demonstrate ligand-interaction induced thermal stabilization with model proteins. The developed Protein-Probe method provides a sensitive approach overcoming the problems of the current label-free methodologies.
中文翻译:

用于蛋白质变性和蛋白质-配体相互作用研究的灵敏的无标记热稳定性分析法。
在现代生物化学中,人们非常关注蛋白质的稳定性和配体之间的相互作用。这些特性经常用需要标记生物分子的方法来研究,因为利用发光外部探针的现有方法灵敏度低。当前可用的无标记技术,例如热移测定,圆二色性和差示扫描量热法,使得能够研究蛋白质展开和蛋白质-配体相互作用(PLI)。不幸的是,所需的微摩尔蛋白浓度增加了成本,并使这些方法自发聚集。在这里,我们报告一种时间分辨的发光方法,用于蛋白质展开和具有纳摩尔灵敏度的PLI检测。Protein-Probe方法基于高度发光的che螯合物偶联探针,这是检测蛋白质解折叠后暴露于溶液中的疏水区域的关键组件。使用相同的Eu-探针,我们还演示了配体相互作用诱导的模型蛋白热稳定作用。发达的Protein-Probe方法提供了一种灵敏的方法,可以克服当前无标记方法的问题。
更新日期:2020-02-13
中文翻译:

用于蛋白质变性和蛋白质-配体相互作用研究的灵敏的无标记热稳定性分析法。
在现代生物化学中,人们非常关注蛋白质的稳定性和配体之间的相互作用。这些特性经常用需要标记生物分子的方法来研究,因为利用发光外部探针的现有方法灵敏度低。当前可用的无标记技术,例如热移测定,圆二色性和差示扫描量热法,使得能够研究蛋白质展开和蛋白质-配体相互作用(PLI)。不幸的是,所需的微摩尔蛋白浓度增加了成本,并使这些方法自发聚集。在这里,我们报告一种时间分辨的发光方法,用于蛋白质展开和具有纳摩尔灵敏度的PLI检测。Protein-Probe方法基于高度发光的che螯合物偶联探针,这是检测蛋白质解折叠后暴露于溶液中的疏水区域的关键组件。使用相同的Eu-探针,我们还演示了配体相互作用诱导的模型蛋白热稳定作用。发达的Protein-Probe方法提供了一种灵敏的方法,可以克服当前无标记方法的问题。





















































 京公网安备 11010802027423号
京公网安备 11010802027423号