当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Understanding the structural basis of HIV-1 restriction by the full length double-domain APOBEC3G.
Nature Communications ( IF 14.7 ) Pub Date : 2020-01-31 , DOI: 10.1038/s41467-020-14377-y
Hanjing Yang 1 , Fumiaki Ito 1 , Aaron D Wolfe 1, 2, 3 , Shuxing Li 1, 4 , Nazanin Mohammadzadeh 5 , Robin P Love 5 , Maocai Yan 1, 6 , Brett Zirkle 1, 2 , Amit Gaba 5 , Linda Chelico 5 , Xiaojiang S Chen 1, 2, 3, 4
Nature Communications ( IF 14.7 ) Pub Date : 2020-01-31 , DOI: 10.1038/s41467-020-14377-y
Hanjing Yang 1 , Fumiaki Ito 1 , Aaron D Wolfe 1, 2, 3 , Shuxing Li 1, 4 , Nazanin Mohammadzadeh 5 , Robin P Love 5 , Maocai Yan 1, 6 , Brett Zirkle 1, 2 , Amit Gaba 5 , Linda Chelico 5 , Xiaojiang S Chen 1, 2, 3, 4
Affiliation
|
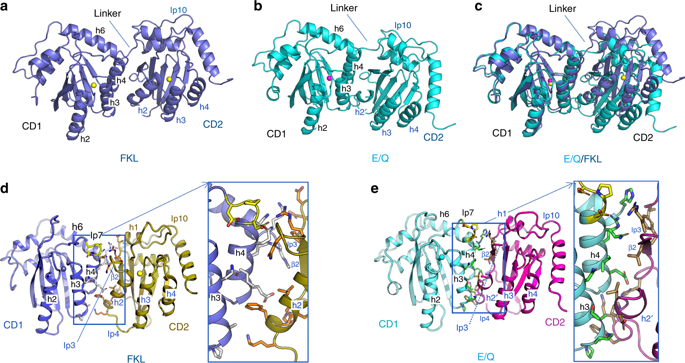
APOBEC3G, a member of the double-domain cytidine deaminase (CD) APOBEC, binds RNA to package into virions and restrict HIV-1 through deamination-dependent or deamination-independent inhibition. Mainly due to lack of a full-length double-domain APOBEC structure, it is unknown how CD1/CD2 domains connect and how dimerization/multimerization is linked to RNA binding and virion packaging for HIV-1 restriction. We report rhesus macaque A3G structures that show different inter-domain packing through a short linker and refolding of CD2. The A3G dimer structure has a hydrophobic dimer-interface matching with that of the previously reported CD1 structure. A3G dimerization generates a surface with intensified positive electrostatic potentials (PEP) for RNA binding and dimer stabilization. Unexpectedly, mutating the PEP surface and the hydrophobic interface of A3G does not abolish virion packaging and HIV-1 restriction. The data support a model in which only one RNA-binding mode is critical for virion packaging and restriction of HIV-1 by A3G.
中文翻译:

了解全长双域 APOBEC3G 限制 HIV-1 的结构基础。
APOBEC3G 是双结构域胞苷脱氨酶 (CD) APOBEC 的成员,通过脱氨依赖性或脱氨依赖性抑制与 RNA 结合包装成病毒粒子并限制 HIV-1。主要由于缺乏全长双结构域 APOBEC 结构,尚不清楚 CD1/CD2 结构域如何连接以及二聚化/多聚化如何与 RNA 结合和 HIV-1 限制的病毒粒子包装相关联。我们报告了恒河猴 A3G 结构,这些结构通过短链接器和 CD2 的重新折叠显示出不同的域间包装。A3G 二聚体结构具有与先前报道的 CD1 结构相匹配的疏水二聚体界面。A3G 二聚化产生具有增强正静电电位 (PEP) 的表面,用于 RNA 结合和二聚体稳定。不料,突变 PEP 表面和 A3G 的疏水界面不会消除病毒粒子包装和 HIV-1 限制。数据支持一个模型,其中只有一种 RNA 结合模式对于病毒粒子包装和 A3G 对 HIV-1 的限制至关重要。
更新日期:2020-01-31
中文翻译:

了解全长双域 APOBEC3G 限制 HIV-1 的结构基础。
APOBEC3G 是双结构域胞苷脱氨酶 (CD) APOBEC 的成员,通过脱氨依赖性或脱氨依赖性抑制与 RNA 结合包装成病毒粒子并限制 HIV-1。主要由于缺乏全长双结构域 APOBEC 结构,尚不清楚 CD1/CD2 结构域如何连接以及二聚化/多聚化如何与 RNA 结合和 HIV-1 限制的病毒粒子包装相关联。我们报告了恒河猴 A3G 结构,这些结构通过短链接器和 CD2 的重新折叠显示出不同的域间包装。A3G 二聚体结构具有与先前报道的 CD1 结构相匹配的疏水二聚体界面。A3G 二聚化产生具有增强正静电电位 (PEP) 的表面,用于 RNA 结合和二聚体稳定。不料,突变 PEP 表面和 A3G 的疏水界面不会消除病毒粒子包装和 HIV-1 限制。数据支持一个模型,其中只有一种 RNA 结合模式对于病毒粒子包装和 A3G 对 HIV-1 的限制至关重要。

































 京公网安备 11010802027423号
京公网安备 11010802027423号