当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Ultrafast Dynamics of Water-Protein Coupled Motions Around the Surface of Eye Crystallin
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2020-01-28 , DOI: 10.1021/jacs.9b13506
Patrick Houston 1, 2 , Nicolas Macro 1 , Minhee Kang 3 , Long Chen 1 , Jin Yang 1 , Lijuan Wang 1 , Zhengrong Wu 2, 3, 4 , Dongping Zhong 1, 2, 3, 4, 5
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2020-01-28 , DOI: 10.1021/jacs.9b13506
Patrick Houston 1, 2 , Nicolas Macro 1 , Minhee Kang 3 , Long Chen 1 , Jin Yang 1 , Lijuan Wang 1 , Zhengrong Wu 2, 3, 4 , Dongping Zhong 1, 2, 3, 4, 5
Affiliation
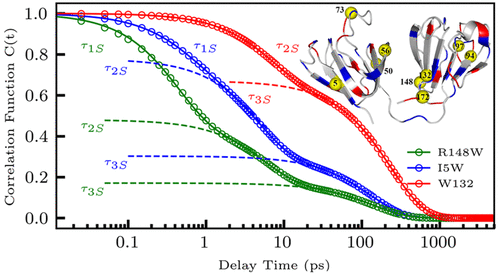
|
Water dynamics on the protein surface mediate both protein structure and function. However, many questions remain about the role of the protein hydration layers in protein fluctuations and how the dynamics of these layers relate to specific protein properties. The fish eye lens protein γM7-crystallin (γM7) is found in vivo at extremely high concentrations nearing the packing limit, corresponding to only a few water layers between adjacent proteins. In this study, we conducted a site-specific probing of hydration water motions and sidechain dynamics at nine selected sites around the surface of γM7 using a tryptophan scan with femtosecond spectroscopy and NMR nuclear spin relaxation (NSR). We observed correlated fluctuations between hydration water and protein sidechains on a few and hundreds of picoseconds, corresponding to local reorientations and network restructuring, respectively. These motions are heterogenous over the protein surface and relate to the various steric and chemical properties of the local protein environment. Overall, we found that γM7 has relatively slower water dynamics within the hydration shell than a similar β-sheet protein, which may contribute to the high packing limit of this unique protein.
中文翻译:

眼睛晶状体蛋白表面水-蛋白质耦合运动的超快动力学
蛋白质表面的水动力学介导蛋白质的结构和功能。然而,关于蛋白质水化层在蛋白质波动中的作用以及这些层的动力学如何与特定蛋白质特性相关,仍然存在许多问题。鱼眼晶状体蛋白 γM7-晶状体蛋白 (γM7) 在体内的浓度极高,接近堆积极限,相当于相邻蛋白质之间仅存在少量水层。在这项研究中,我们使用飞秒光谱和 NMR 核自旋弛豫 (NSR) 色氨酸扫描,在 γM7 表面周围的九个选定位点对水合水运动和侧链动力学进行了位点特异性探测。我们观察到水合水和蛋白质侧链之间在几皮秒和数百皮秒内的相关波动,分别对应于局部重新定向和网络重组。这些运动在蛋白质表面上是异质的,并且与局部蛋白质环境的各种空间和化学性质有关。总体而言,我们发现 γM7 在水合壳内的水动力学比类似的 β-折叠蛋白相对较慢,这可能导致这种独特蛋白质的高堆积极限。
更新日期:2020-01-28
中文翻译:

眼睛晶状体蛋白表面水-蛋白质耦合运动的超快动力学
蛋白质表面的水动力学介导蛋白质的结构和功能。然而,关于蛋白质水化层在蛋白质波动中的作用以及这些层的动力学如何与特定蛋白质特性相关,仍然存在许多问题。鱼眼晶状体蛋白 γM7-晶状体蛋白 (γM7) 在体内的浓度极高,接近堆积极限,相当于相邻蛋白质之间仅存在少量水层。在这项研究中,我们使用飞秒光谱和 NMR 核自旋弛豫 (NSR) 色氨酸扫描,在 γM7 表面周围的九个选定位点对水合水运动和侧链动力学进行了位点特异性探测。我们观察到水合水和蛋白质侧链之间在几皮秒和数百皮秒内的相关波动,分别对应于局部重新定向和网络重组。这些运动在蛋白质表面上是异质的,并且与局部蛋白质环境的各种空间和化学性质有关。总体而言,我们发现 γM7 在水合壳内的水动力学比类似的 β-折叠蛋白相对较慢,这可能导致这种独特蛋白质的高堆积极限。































 京公网安备 11010802027423号
京公网安备 11010802027423号