Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Ring Finger Protein 11 通过与 ANKRD13 蛋白家族的 UIM 区域直接相互作用,作用于配体激活的 EGFR。
The FEBS Journal ( IF 5.5 ) Pub Date : 2020-01-27 , DOI: 10.1111/febs.15226
Anna Mattioni 1 , Karsten Boldt 2 , Giulio Auciello 3 , Masayuki Komada 4 , Joshua Z Rappoport 5 , Marius Ueffing 2 , Luisa Castagnoli 1 , Gianni Cesareni 1, 6 , Elena Santonico 1
Affiliation
|
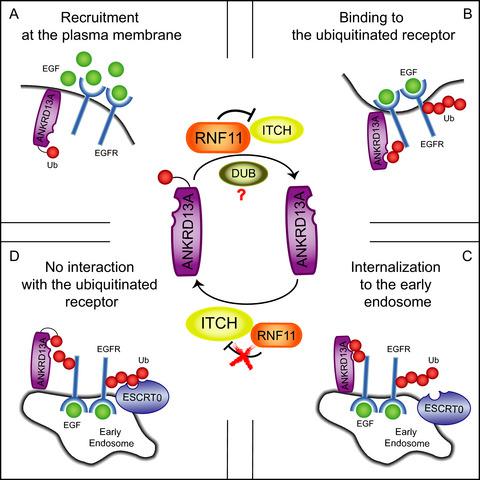
RING Finger Protein 11 (RNF11) 是一种进化保守的、真正有趣的新基因 E3 连接酶,在多种人类肿瘤中过度表达。尽管一些报告强调了它参与关键的细胞过程,但其功能背后的机制细节仍然知之甚少。利用基于培养物氨基酸稳定同位素标记 (SILAC) 的蛋白质组学分析,我们鉴定了 51 种与野生型 RNF11 和/或其催化失活突变体共免疫沉淀的蛋白质。我们将注意力集中在 RNF11 与含有锚蛋白重复结构域的蛋白 13 (ANKRD13) 家族的相互作用上。 ANKRD13 家族的成员包含泛素相互作用基序 (UIM),可识别配体结合后不久附加到表皮生长因子受体 (EGFR) 的 Lys-63 连接泛素 (Ub) 链。我们发现 ANKRD13A、ANKRD13B 和 ANKRD13D在体内与 RNF11 形成复合物,并且 UIM 是复合物形成所必需的。然而,与传统的 UIM 结合模式不同,RNF11 的 Ub 修饰并不是与 ANKRD13 蛋白相互作用所必需的。我们还表明,ANKRD13A 和 RNF11 之间的相互作用受到 EGF 刺激的调节,并且由 ANKRD13A、RNF11 和激活的 EGFR 形成的复合物在受体内吞作用的早期阶段短暂组装。此外,E3 连接酶 Itchy E3 泛素蛋白连接酶 (ITTCH) 或 RNF11 的功能丧失分别会消除或增加内源性 ANKRD13A 的泛素化,影响其结合活化 EGFR 的能力。我们提出了一个模型,其中 ANKRD13 蛋白充当分子支架,促进激活的 EGFR 与 E3 连接酶 ITCH 和 RNF11 之间复合物的瞬时形成。 通过调节 ANKRD13A 的泛素化状态及其内吞接头功能,RNF11 促进激活的 EGFR 的分选以进行溶酶体降解。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号