当前位置:
X-MOL 学术
›
Anal. Chim. Acta
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Development of Sandwich Chemiluminescent Immunoassay based on an Anti-Staphylococcal enterotoxin B Nanobody–Alkaline Phosphatase Fusion Protein for Detection of Staphylococcal Enterotoxin B
Analytica Chimica Acta ( IF 5.7 ) Pub Date : 2020-04-01 , DOI: 10.1016/j.aca.2020.01.032 Tieqiang Sun , Zunquan Zhao , Wentao Liu , Zehua Xu , Hongwei He , Baoan Ning , Yongqiang Jiang , Zhixian Gao
Analytica Chimica Acta ( IF 5.7 ) Pub Date : 2020-04-01 , DOI: 10.1016/j.aca.2020.01.032 Tieqiang Sun , Zunquan Zhao , Wentao Liu , Zehua Xu , Hongwei He , Baoan Ning , Yongqiang Jiang , Zhixian Gao
|
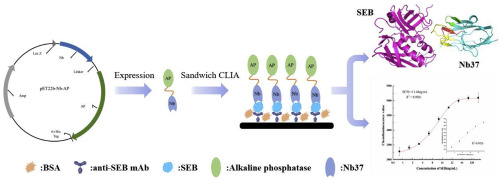
In this study, sandwich chemiluminescent immunoassay (CLIA) for the detection of Staphylococcal enterotoxin B (SEB) was developed using nanobody-alkaline phosphatase (Nb-ALP) fusion protein. The SEB-binding nanobodies were obtained from a naïve phage-display library and the Nb-ALP fusion protein was constructed and obtained as a thermally stable and potentially effective substance for detecting antibodies in CLIA. The working range of the sandwich CLIA based on anti-SEB monoclonal antibodies (mAbs) and our fusion protein, Nb37-ALP, was 3.12-50.0 ng mL-1 with SC50 = 8.59 ± 0.37 ng mL-1. The limit of detection was 1.44 ng mL-1 according to the blank value plus 3 standard deviations. In order to understand the interaction of SEB and Nb37 in depth, the 3D structure of the SEB-Nb37 complex was constructed and verified by molecular modeling and the docking method. The results showed that the complementary-determining region 3 (CDR3) of Nb37 embedded itself in the opening generated by the major histocompatibility complex (MHC) and T-cell receptor- (TcR) binding sites of SEB, indicating that Nb37 may affect the recognition of SEB by MHC class Ⅱ molecules and the TcR. The arginine residue (Arg) 101, Arg102 and phenylalanine residue (Phe)103 of CDR3 in Nb37 may have contributed to specific binding to form six salt-bridges between these and SEB. In conclusion, in terms of their specificity and sensitivity, the obtained anti-SEB Nb-ALP appears to have the potential to replace chemically labeled probes for the detection of SEB.
中文翻译:

基于抗葡萄球菌肠毒素 B 纳米抗体-碱性磷酸酶融合蛋白的夹心化学发光免疫测定法的开发,用于检测葡萄球菌肠毒素 B
在这项研究中,使用纳米抗体-碱性磷酸酶 (Nb-ALP) 融合蛋白开发了用于检测葡萄球菌肠毒素 B (SEB) 的夹心化学发光免疫分析 (CLIA)。SEB 结合纳米抗体从初始噬菌体展示库中获得,Nb-ALP 融合蛋白被构建并获得,作为一种热稳定且潜在有效的物质,用于检测 CLIA 中的抗体。基于抗 SEB 单克隆抗体 (mAb) 和我们的融合蛋白 Nb37-ALP 的夹心 CLIA 的工作范围为 3.12-50.0 ng mL-1,SC50 = 8.59 ± 0.37 ng mL-1。根据空白值加上 3 个标准偏差,检测限为 1.44 ng mL-1。为了深入了解SEB和Nb37的相互作用,通过分子建模和对接方法构建并验证了 SEB-Nb37 复合物的 3D 结构。结果表明,Nb37 的互补决定区 3(CDR3)将自身嵌入由 SEB 的主要组织相容性复合体(MHC)和 T 细胞受体(TcR)结合位点产生的开口中,表明 Nb37 可能影响识别SEB 通过 MHC Ⅱ类分子和 TcR。Nb37 中 CDR3 的精氨酸残基 (Arg) 101、Arg102 和苯丙氨酸残基 (Phe)103 可能有助于特异性结合,在这些和 SEB 之间形成六个盐桥。总之,就其特异性和灵敏度而言,所获得的抗 SEB Nb-ALP 似乎有可能取代化学标记的探针来检测 SEB。结果表明,Nb37 的互补决定区 3(CDR3)将自身嵌入由 SEB 的主要组织相容性复合体(MHC)和 T 细胞受体(TcR)结合位点产生的开口中,表明 Nb37 可能影响识别SEB 通过 MHC Ⅱ类分子和 TcR。Nb37 中 CDR3 的精氨酸残基 (Arg) 101、Arg102 和苯丙氨酸残基 (Phe)103 可能有助于特异性结合,在这些和 SEB 之间形成六个盐桥。总之,就其特异性和灵敏度而言,所获得的抗 SEB Nb-ALP 似乎有可能取代化学标记的探针来检测 SEB。结果表明,Nb37 的互补决定区 3(CDR3)将自身嵌入由 SEB 的主要组织相容性复合体(MHC)和 T 细胞受体(TcR)结合位点产生的开口中,表明 Nb37 可能影响识别SEB 通过 MHC Ⅱ类分子和 TcR。Nb37 中 CDR3 的精氨酸残基 (Arg) 101、Arg102 和苯丙氨酸残基 (Phe)103 可能有助于特异性结合,在这些和 SEB 之间形成六个盐桥。总之,就其特异性和灵敏度而言,所获得的抗 SEB Nb-ALP 似乎有可能取代化学标记的探针来检测 SEB。表明 Nb37 可能影响 MHC Ⅱ类分子和 TcR 对 SEB 的识别。Nb37 中 CDR3 的精氨酸残基 (Arg) 101、Arg102 和苯丙氨酸残基 (Phe)103 可能有助于特异性结合,在这些和 SEB 之间形成六个盐桥。总之,就其特异性和灵敏度而言,所获得的抗 SEB Nb-ALP 似乎有可能取代化学标记的探针来检测 SEB。表明 Nb37 可能影响 MHC Ⅱ类分子和 TcR 对 SEB 的识别。Nb37 中 CDR3 的精氨酸残基 (Arg) 101、Arg102 和苯丙氨酸残基 (Phe)103 可能有助于特异性结合,在这些和 SEB 之间形成六个盐桥。总之,就其特异性和灵敏度而言,所获得的抗 SEB Nb-ALP 似乎有可能取代化学标记的探针来检测 SEB。
更新日期:2020-04-01
中文翻译:

基于抗葡萄球菌肠毒素 B 纳米抗体-碱性磷酸酶融合蛋白的夹心化学发光免疫测定法的开发,用于检测葡萄球菌肠毒素 B
在这项研究中,使用纳米抗体-碱性磷酸酶 (Nb-ALP) 融合蛋白开发了用于检测葡萄球菌肠毒素 B (SEB) 的夹心化学发光免疫分析 (CLIA)。SEB 结合纳米抗体从初始噬菌体展示库中获得,Nb-ALP 融合蛋白被构建并获得,作为一种热稳定且潜在有效的物质,用于检测 CLIA 中的抗体。基于抗 SEB 单克隆抗体 (mAb) 和我们的融合蛋白 Nb37-ALP 的夹心 CLIA 的工作范围为 3.12-50.0 ng mL-1,SC50 = 8.59 ± 0.37 ng mL-1。根据空白值加上 3 个标准偏差,检测限为 1.44 ng mL-1。为了深入了解SEB和Nb37的相互作用,通过分子建模和对接方法构建并验证了 SEB-Nb37 复合物的 3D 结构。结果表明,Nb37 的互补决定区 3(CDR3)将自身嵌入由 SEB 的主要组织相容性复合体(MHC)和 T 细胞受体(TcR)结合位点产生的开口中,表明 Nb37 可能影响识别SEB 通过 MHC Ⅱ类分子和 TcR。Nb37 中 CDR3 的精氨酸残基 (Arg) 101、Arg102 和苯丙氨酸残基 (Phe)103 可能有助于特异性结合,在这些和 SEB 之间形成六个盐桥。总之,就其特异性和灵敏度而言,所获得的抗 SEB Nb-ALP 似乎有可能取代化学标记的探针来检测 SEB。结果表明,Nb37 的互补决定区 3(CDR3)将自身嵌入由 SEB 的主要组织相容性复合体(MHC)和 T 细胞受体(TcR)结合位点产生的开口中,表明 Nb37 可能影响识别SEB 通过 MHC Ⅱ类分子和 TcR。Nb37 中 CDR3 的精氨酸残基 (Arg) 101、Arg102 和苯丙氨酸残基 (Phe)103 可能有助于特异性结合,在这些和 SEB 之间形成六个盐桥。总之,就其特异性和灵敏度而言,所获得的抗 SEB Nb-ALP 似乎有可能取代化学标记的探针来检测 SEB。结果表明,Nb37 的互补决定区 3(CDR3)将自身嵌入由 SEB 的主要组织相容性复合体(MHC)和 T 细胞受体(TcR)结合位点产生的开口中,表明 Nb37 可能影响识别SEB 通过 MHC Ⅱ类分子和 TcR。Nb37 中 CDR3 的精氨酸残基 (Arg) 101、Arg102 和苯丙氨酸残基 (Phe)103 可能有助于特异性结合,在这些和 SEB 之间形成六个盐桥。总之,就其特异性和灵敏度而言,所获得的抗 SEB Nb-ALP 似乎有可能取代化学标记的探针来检测 SEB。表明 Nb37 可能影响 MHC Ⅱ类分子和 TcR 对 SEB 的识别。Nb37 中 CDR3 的精氨酸残基 (Arg) 101、Arg102 和苯丙氨酸残基 (Phe)103 可能有助于特异性结合,在这些和 SEB 之间形成六个盐桥。总之,就其特异性和灵敏度而言,所获得的抗 SEB Nb-ALP 似乎有可能取代化学标记的探针来检测 SEB。表明 Nb37 可能影响 MHC Ⅱ类分子和 TcR 对 SEB 的识别。Nb37 中 CDR3 的精氨酸残基 (Arg) 101、Arg102 和苯丙氨酸残基 (Phe)103 可能有助于特异性结合,在这些和 SEB 之间形成六个盐桥。总之,就其特异性和灵敏度而言,所获得的抗 SEB Nb-ALP 似乎有可能取代化学标记的探针来检测 SEB。




















































 京公网安备 11010802027423号
京公网安备 11010802027423号