Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
来自大肠杆菌的 YqfB 蛋白:一种对 N4-酰基胞嘧啶衍生物具有活性的非典型酰胺水解酶。
Scientific Reports ( IF 3.8 ) Pub Date : 2020-01-21 , DOI: 10.1038/s41598-020-57664-w Rūta Stanislauskienė 1 , Audrius Laurynėnas 2 , Rasa Rutkienė 1 , Agota Aučynaitė 1 , Daiva Tauraitė 1 , Rita Meškienė 1 , Nina Urbelienė 1 , Algirdas Kaupinis 3 , Mindaugas Valius 3 , Laura Kaliniene 1 , Rolandas Meškys 1
Affiliation
|
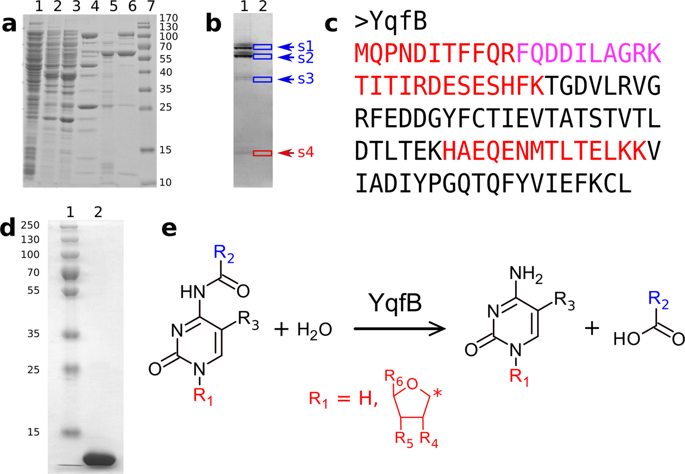
含有人类激活信号协整同源(ASCH)结构域的蛋白质广泛且多样,但目前,这些蛋白质中的绝大多数还没有指定的功能。这项研究表明,之前假设的 103 个氨基酸的大肠杆菌蛋白 YqfB 是一种独特的含有 ASCH 结构域的酰胺水解酶,负责 N4-乙酰胞苷 (ac4C) 的分解代谢。 YqfB 有几个有趣且独特的特征:i) 它是迄今为止描述的最小的单体酰胺水解酶,ii) 它对结构不同的 N4-酰化胞嘧啶/胞苷具有活性,iii) 它对这些底物具有高度特异性 (kcat/Km)高达 2.8 × 106 M-1 s-1)。此外,我们的结果表明,YqfB 含有独特的 Thr-Lys-Glu 催化三联体,Arg 充当氧阴离子孔。缺乏 yqfB 基因的突变体保留了以 N4-乙酰胞嘧啶作为尿嘧啶来源生长的能力,尽管很差,这表明大肠杆菌中存在利用该化合物的替代途径。总体而言,YqfB 水解各种 N4 酰化胞嘧啶和胞苷的能力不仅揭示了 ac4C 在细菌中如何分解代谢的长期谜团,而且还扩展了我们对酰胺水解酶活性位点内结构多样性的了解。

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号