当前位置:
X-MOL 学术
›
Cell Death Dis.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
ADT-OH, a hydrogen sulfide-releasing donor, induces apoptosis and inhibits the development of melanoma in vivo by upregulating FADD.
Cell Death & Disease ( IF 8.1 ) Pub Date : 2020-01-16 , DOI: 10.1038/s41419-020-2222-9 Fangfang Cai 1 , Huangru Xu 1 , Nini Cao 1 , Xiangyu Zhang 1 , Jia Liu 1 , Yanyan Lu 1 , Jia Chen 1 , Yunwen Yang 1 , Jian Cheng 2 , Zi-Chun Hua 1, 3 , Hongqin Zhuang 1
Cell Death & Disease ( IF 8.1 ) Pub Date : 2020-01-16 , DOI: 10.1038/s41419-020-2222-9 Fangfang Cai 1 , Huangru Xu 1 , Nini Cao 1 , Xiangyu Zhang 1 , Jia Liu 1 , Yanyan Lu 1 , Jia Chen 1 , Yunwen Yang 1 , Jian Cheng 2 , Zi-Chun Hua 1, 3 , Hongqin Zhuang 1
Affiliation
|
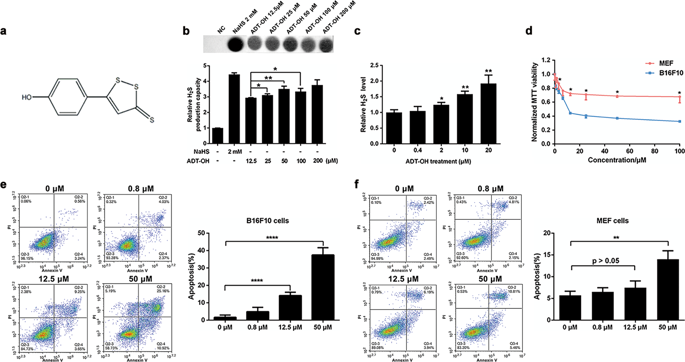
Hydrogen sulfide (H2S) is now widely considered the third endogenous gasotransmitter and plays critical roles in cancer biological processes. In this study, we demonstrate that 5-(4-hydroxyphenyl)-3H-1,2-dithiole-3-thione (ADT-OH), the most widely used moiety for synthesising slow-releasing H2S donors, induces melanoma cell death in vitro and in vivo. Consistent with previous reports, ADT-OH inhibited IκBɑ degradation, resulting in reduced NF-κB activation and subsequent downregulation of the NF-κB-targeted anti-apoptotic proteins XIAP and Bcl-2. More importantly, we found that ADT-OH suppressed the ubiquitin-induced degradation of FADD by downregulating the expression of MKRN1, an E3 ubiquitin ligase of FADD. In addition, ADT-OH had no significant therapeutic effect on FADD-knockout B16F0 cells or FADD-knockdown A375 cells. Based on these findings, we evaluated the combined effects of ADT-OH treatment and FADD overexpression on melanoma cell death in vivo using a mouse xenograft model. As expected, tumour-specific delivery of FADD through a recombinant Salmonella strain, VNP-FADD, combined with low-dose ADT-OH treatment significantly inhibited tumour growth and induced cancer cell apoptosis. Taken together, our data suggest that ADT-OH is a promising cancer therapeutic drug that warrants further investigation into its potential clinical applications.
中文翻译:

ADT-OH是一种释放硫化氢的供体,可通过上调FADD诱导细胞凋亡并在体内抑制黑色素瘤的发展。
硫化氢(H2S)现在被广泛认为是第三种内源性气体递质,在癌症生物过程中起着关键作用。在这项研究中,我们证明5-(4-羟苯基)-3H-1,2-二硫基-3-硫酮(ADT-OH)是合成缓慢释放H2S供体的最广泛使用的部分,可诱导黑素瘤细胞死亡。体外和体内。与以前的报道一致,ADT-OH抑制IκBɑ降解,导致NF-κB激活减少,随后NF-κB靶向的抗凋亡蛋白XIAP和Bcl-2的下调。更重要的是,我们发现ADT-OH通过下调FADD的E3泛素连接酶MKRN1的表达来抑制泛素诱导的FADD降解。另外,ADT-OH对FADD敲除的B16F0细胞或FADD敲除的A375细胞没有明显的治疗作用。基于这些发现,我们使用小鼠异种移植模型评估了ADT-OH治疗和FADD过表达对体内黑色素瘤细胞死亡的综合作用。如预期的那样,通过重组沙门氏菌菌株VNP-FADD与低剂量ADT-OH处理的肿瘤特异性FADD递送显着抑制了肿瘤生长并诱导了癌细胞凋亡。综上所述,我们的数据表明ADT-OH是一种有前途的癌症治疗药物,值得对其潜在的临床应用进行进一步的研究。结合小剂量ADT-OH治疗可显着抑制肿瘤生长并诱导癌细胞凋亡。综上所述,我们的数据表明ADT-OH是一种有前途的癌症治疗药物,值得对其潜在的临床应用进行进一步的研究。结合小剂量ADT-OH治疗可显着抑制肿瘤生长并诱导癌细胞凋亡。综上所述,我们的数据表明ADT-OH是一种有前途的癌症治疗药物,值得对其潜在的临床应用进行进一步的研究。
更新日期:2020-01-17
中文翻译:

ADT-OH是一种释放硫化氢的供体,可通过上调FADD诱导细胞凋亡并在体内抑制黑色素瘤的发展。
硫化氢(H2S)现在被广泛认为是第三种内源性气体递质,在癌症生物过程中起着关键作用。在这项研究中,我们证明5-(4-羟苯基)-3H-1,2-二硫基-3-硫酮(ADT-OH)是合成缓慢释放H2S供体的最广泛使用的部分,可诱导黑素瘤细胞死亡。体外和体内。与以前的报道一致,ADT-OH抑制IκBɑ降解,导致NF-κB激活减少,随后NF-κB靶向的抗凋亡蛋白XIAP和Bcl-2的下调。更重要的是,我们发现ADT-OH通过下调FADD的E3泛素连接酶MKRN1的表达来抑制泛素诱导的FADD降解。另外,ADT-OH对FADD敲除的B16F0细胞或FADD敲除的A375细胞没有明显的治疗作用。基于这些发现,我们使用小鼠异种移植模型评估了ADT-OH治疗和FADD过表达对体内黑色素瘤细胞死亡的综合作用。如预期的那样,通过重组沙门氏菌菌株VNP-FADD与低剂量ADT-OH处理的肿瘤特异性FADD递送显着抑制了肿瘤生长并诱导了癌细胞凋亡。综上所述,我们的数据表明ADT-OH是一种有前途的癌症治疗药物,值得对其潜在的临床应用进行进一步的研究。结合小剂量ADT-OH治疗可显着抑制肿瘤生长并诱导癌细胞凋亡。综上所述,我们的数据表明ADT-OH是一种有前途的癌症治疗药物,值得对其潜在的临床应用进行进一步的研究。结合小剂量ADT-OH治疗可显着抑制肿瘤生长并诱导癌细胞凋亡。综上所述,我们的数据表明ADT-OH是一种有前途的癌症治疗药物,值得对其潜在的临床应用进行进一步的研究。






























 京公网安备 11010802027423号
京公网安备 11010802027423号