当前位置:
X-MOL 学术
›
Environ. Sci. Technol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Effect of Cu(II) on Mn(II) Oxidation by Free Chlorine To Form Mn Oxides at Drinking Water Conditions.
Environmental Science & Technology ( IF 10.8 ) Pub Date : 2020-01-14 , DOI: 10.1021/acs.est.9b06497 Guiwei Li 1, 2, 3 , Weiyi Pan 2 , Lili Zhang 1 , Ziqiao Wang 1 , Baoyou Shi 1, 3 , Daniel E Giammar 2
Environmental Science & Technology ( IF 10.8 ) Pub Date : 2020-01-14 , DOI: 10.1021/acs.est.9b06497 Guiwei Li 1, 2, 3 , Weiyi Pan 2 , Lili Zhang 1 , Ziqiao Wang 1 , Baoyou Shi 1, 3 , Daniel E Giammar 2
Affiliation
|
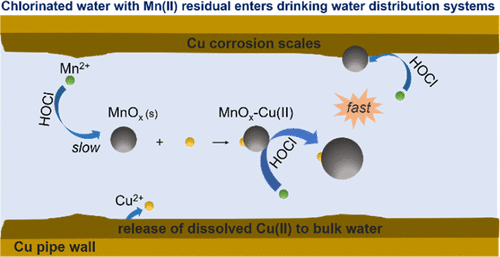
The chemical oxidation of dissolved Mn(II) to Mn(III/IV) oxides (MnOx) can lead to the accumulation of Mn deposits in drinking water distribution systems. However, Mn(II) oxidation by free chlorine is quite slow under mild conditions (e.g., pH 7.7 and 1.0 mg/L Cl2). This study found a significant role for Cu(II) in Mn(II) oxidation under conditions relevant to the supply of chlorinated drinking water. At pH 7.7, dissolved Cu(II) accelerated Mn(II) oxidation more than 10 times with a dose of 20 μg/L. Solid characterization revealed that during Mn(II) oxidation, Cu(II) adsorbed to freshly formed MnOx and produced Mn-Cu mixtures (denoted as MnOx-Cu(II)). An autocatalytic model for the reaction kinetics suggested that the freshly formed MnOx-Cu(II) had a much higher catalytic activity than that of pure MnOx. Solid CuO also catalyzed Mn(II) oxidation, and kinetic modeling indicated that after an initial oxidation of Mn(II) facilitated by the CuO surface, the freshly formed MnOx-Cu(II) on CuO surface played the dominant role in accelerating further Mn(II) oxidation. This study indicates a high potential for the formation of Mn oxides at locations in a drinking water distribution system or in premise plumbing where both Mn(II) and Cu(II) are available. It provides insights into the co-occurrence of other metals with Mn deposits that is frequently observed in distribution systems.
中文翻译:

Cu(II)对饮用水中游离氯氧化Mn(II)形成Mn氧化物的影响。
溶解的Mn(II)氧化成Mn(III / IV)氧化物(MnOx)的化学氧化可导致饮用水分配系统中Mn沉积物的积累。但是,在温和条件下(例如pH 7.7和1.0 mg / L Cl2),游离氯对Mn(II)的氧化非常缓慢。这项研究发现,在与氯化饮用水供应有关的条件下,Cu(II)在Mn(II)氧化中起着重要作用。在pH 7.7下,以20μg/ L的剂量,溶解的Cu(II)促进Mn(II)氧化超过10倍。固体表征表明,在Mn(II)氧化过程中,Cu(II)吸附到新形成的MnOx上并生成Mn-Cu混合物(表示为MnOx-Cu(II))。反应动力学的自动催化模型表明,新形成的MnOx-Cu(II)具有比纯MnOx更高的催化活性。固态CuO还催化Mn(II)氧化,动力学模型表明,CuO表面促进了Mn(II)的初始氧化后,CuO表面上新形成的MnOx-Cu(II)在进一步促进Mn(II)氧化中起主要作用。这项研究表明,在饮用水分配系统中或既有Mn(II)也有Cu(II)的自来水管道中,形成锰氧化物的可能性很高。它提供了分布系统中经常观察到的其他金属与锰沉积物共存的见解。这项研究表明,在饮用水分配系统中或既有Mn(II)也有Cu(II)的自来水管道中,形成锰氧化物的可能性很高。它提供了分布系统中经常观察到的其他金属与锰沉积物共存的见解。这项研究表明,在饮用水分配系统中或既有Mn(II)也有Cu(II)的自来水管道中,形成锰氧化物的可能性很高。它提供了分布系统中经常观察到的其他金属与锰沉积物共存的见解。
更新日期:2020-01-15
中文翻译:

Cu(II)对饮用水中游离氯氧化Mn(II)形成Mn氧化物的影响。
溶解的Mn(II)氧化成Mn(III / IV)氧化物(MnOx)的化学氧化可导致饮用水分配系统中Mn沉积物的积累。但是,在温和条件下(例如pH 7.7和1.0 mg / L Cl2),游离氯对Mn(II)的氧化非常缓慢。这项研究发现,在与氯化饮用水供应有关的条件下,Cu(II)在Mn(II)氧化中起着重要作用。在pH 7.7下,以20μg/ L的剂量,溶解的Cu(II)促进Mn(II)氧化超过10倍。固体表征表明,在Mn(II)氧化过程中,Cu(II)吸附到新形成的MnOx上并生成Mn-Cu混合物(表示为MnOx-Cu(II))。反应动力学的自动催化模型表明,新形成的MnOx-Cu(II)具有比纯MnOx更高的催化活性。固态CuO还催化Mn(II)氧化,动力学模型表明,CuO表面促进了Mn(II)的初始氧化后,CuO表面上新形成的MnOx-Cu(II)在进一步促进Mn(II)氧化中起主要作用。这项研究表明,在饮用水分配系统中或既有Mn(II)也有Cu(II)的自来水管道中,形成锰氧化物的可能性很高。它提供了分布系统中经常观察到的其他金属与锰沉积物共存的见解。这项研究表明,在饮用水分配系统中或既有Mn(II)也有Cu(II)的自来水管道中,形成锰氧化物的可能性很高。它提供了分布系统中经常观察到的其他金属与锰沉积物共存的见解。这项研究表明,在饮用水分配系统中或既有Mn(II)也有Cu(II)的自来水管道中,形成锰氧化物的可能性很高。它提供了分布系统中经常观察到的其他金属与锰沉积物共存的见解。




















































 京公网安备 11010802027423号
京公网安备 11010802027423号