Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
酪氨酸脱羧酶的晶体结构以及与构象摆动和底物结合有关的关键残基的鉴定。
Scientific Reports ( IF 3.8 ) Pub Date : 2016-06-13 , DOI: 10.1038/srep27779 Haixia Zhu , Guochao Xu , Kai Zhang , Xudong Kong , Ruizhi Han , Jiahai Zhou , Ye Ni
Scientific Reports ( IF 3.8 ) Pub Date : 2016-06-13 , DOI: 10.1038/srep27779 Haixia Zhu , Guochao Xu , Kai Zhang , Xudong Kong , Ruizhi Han , Jiahai Zhou , Ye Ni
|
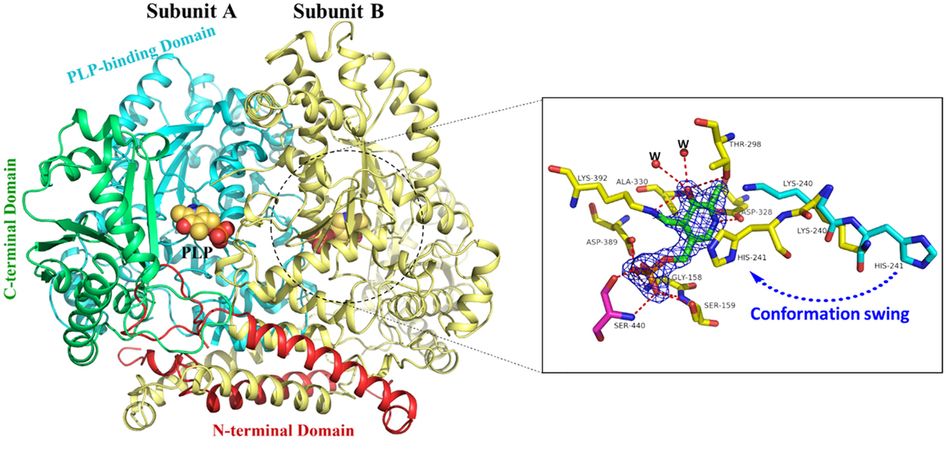
酪氨酸脱羧酶(TDC)是一种依赖于吡ido醛的5磷酸(PLP)酶,主要负责酪胺的合成,酪胺是一种重要的生物胺。在这项研究中,确定了短乳杆菌TDC(LbTDC)的载脂蛋白和全环形式的晶体结构。LbTDC与唯一报告的TDC结构仅显示25%的序列同一性。对构象柔性位点和催化中心进行了定点诱变,以研究潜在的催化机理。发现活性位点中的H241在PLP结合中起重要作用,因为它在LbTDC的脱辅基和整个结构中具有不同的构象。与PLP结合后,H241旋转至与PLP吡啶环相邻的位置。丙氨酸扫描诱变揭示了确定底物特异性和催化活性的几个关键区域。在突变体中,S586A变体表现出增加的催化效率和底物亲和力,这归因于减少的位阻和增加的疏水性,如在S586处的饱和诱变所证实的。我们的结果提供了有关残基的结构信息,这些残基对于TDC的蛋白质工程对提高绿色制造酪胺的催化效率很重要。

"点击查看英文标题和摘要"
更新日期:2016-06-15

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号