当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
翻译后 Claisen 缩合和脱羧在到达泛霉素 A 的双环核心的途中
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2016-04-22 , DOI: 10.1021/jacs.5b13529
Swapnil V Ghodge 1 , Kristen A Biernat 2 , Sarah Jane Bassett 1 , Matthew R Redinbo 2 , Albert A Bowers 1
Affiliation
|
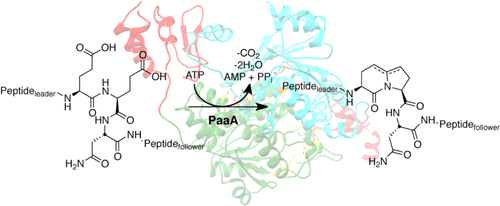
Pantocin A (PA) 是不断增长的核糖体编码和翻译后修饰肽天然产物 (RiPP) 家族的成员。PA 比大多数已知的 RiPP 小得多,RiPP 是一种具有紧密双环核心的三肽,似乎是从较大的 30 个残基前体肽的中间裂解而来的。我们在这里表明,酶 PaaA 催化 30 个残基前体 PaaP 中两个谷氨酸残基的双重脱水和脱羧。PaaP 前导肽序列和跟随肽序列的进一步截短表明了这两个区域对 PaaA 介导的定制的不同影响,并描述了跟随序列在脱羧步骤中的重要作用。报道了 apo PaaA 的晶体结构,从而可以识别使 PaaA 有别于其他同源酶的结构特征,这些酶通常不会催化这种扩展的翻译后化学反应。总之,这些数据揭示了如何从无处不在的酶家族中提取额外的化学成分,以实现核糖体衍生的肽天然产物生物合成,并表明在未开发的基因组空间中可能存在更多此类酶的例子。

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号