当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Emergence of Function in P450-Proteins: A Combined Quantum Mechanical/Molecular Mechanical and Molecular Dynamics Study of the Reactive Species in the H2O2-Dependent Cytochrome P450SPαand Its Regio- and Enantioselective Hydroxylation of Fatty Acids
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2016-04-22 , DOI: 10.1021/jacs.6b01716 Rajeev Ramanan 1 , Kshatresh Dutta Dubey 1 , Binju Wang 1 , Debasish Mandal 1 , Sason Shaik 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2016-04-22 , DOI: 10.1021/jacs.6b01716 Rajeev Ramanan 1 , Kshatresh Dutta Dubey 1 , Binju Wang 1 , Debasish Mandal 1 , Sason Shaik 1
Affiliation
|
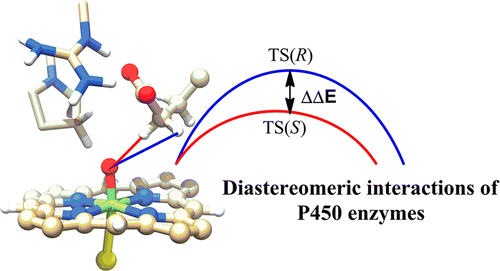
This work uses combined quantum mechanical/molecular mechanical and molecular dynamics simulations to investigate the mechanism and selectivity of H2O2-dependent hydroxylation of fatty acids by the P450SPα class of enzymes. H2O2 is found to serve as the surrogate oxidant for generating the principal oxidant, Compound I (Cpd I), in a mechanism that involves homolytic O-O bond cleavage followed by H-abstraction from the Fe-OH moiety. Our results rule out a substrate-assisted heterolytic cleavage of H2O2 en route to Cpd I. We show, however, that substrate binding stabilizes the resultant Fe-H2O2 complex, which is crucial for the formation of Cpd I in the homolytic pathway. A network of hydrogen bonds locks the HO· radical, formed by the O-O homolysis, thus directing it to exclusively abstract the hydrogen atom from Fe-OH, thereby forming Cpd I, while preventing the autoxoidative reaction, with the porphyrin ligand, and the substrate oxidation. The so formed Cpd I subsequently hydroxylates fatty acids at their α-position with S-enantioselectivity. These selectivity patterns are controlled by the active site: substrate's binding by Arg241 determines the α-regioselectivity, while the Pro242 residue locks the prochiral α-CH2, thereby leading to hydroxylation of the pro-S C-H bond. Our study of the mutant Pro242Ala sheds light on potential modifications of the enzyme's active site in order to modify reaction selectivity. Comparisons of P450SPα to P450BM3 and to P450BSβ reveal that function has evolved in these related metalloenzymes by strategically placing very few residues in the active site.
中文翻译:

P450-蛋白质功能的出现:对依赖 H2O2 的细胞色素 P450SPα 中反应性物质的组合量子力学/分子力学和分子动力学研究及其脂肪酸的区域和对映选择性羟基化
这项工作使用组合的量子力学/分子力学和分子动力学模拟来研究 P450SPα 类酶对脂肪酸的 H2O2 依赖性羟基化的机制和选择性。发现 H2O2 作为替代氧化剂用于生成主要氧化剂化合物 I (Cpd I),其机制涉及均裂 OO 键裂解,然后从 Fe-OH 部分提取 H。我们的结果排除了 H2O2 在到达 Cpd I 的过程中的底物辅助异裂裂解。 然而,我们表明,底物结合稳定了所得的 Fe-H2O2 复合物,这对于均溶途径中 Cpd I 的形成至关重要。氢键网络锁定了由 OO 均裂形成的 HO· 自由基,从而引导它从 Fe-OH 中专门提取氢原子,从而形成 Cpd I,同时防止与卟啉配体和底物氧化的自氧化反应。如此形成的Cpd I随后在脂肪酸的α-位以S-对映选择性羟基化脂肪酸。这些选择性模式由活性位点控制:底物与 Arg241 的结合决定了 α-区域选择性,而 Pro242 残基锁定前手性 α-CH2,从而导致 pro-S CH 键的羟基化。我们对突变体 Pro242Ala 的研究揭示了酶活性位点的潜在修饰,以改变反应选择性。P450SPα 与 P450BM3 和 P450BSβ 的比较表明,通过在活性位点战略性地放置很少的残基,这些相关金属酶的功能已经进化。和底物氧化。如此形成的Cpd I随后在脂肪酸的α-位以S-对映选择性羟基化脂肪酸。这些选择性模式由活性位点控制:底物与 Arg241 的结合决定了 α-区域选择性,而 Pro242 残基锁定前手性 α-CH2,从而导致 pro-S CH 键的羟基化。我们对突变体 Pro242Ala 的研究揭示了酶活性位点的潜在修饰,以改变反应选择性。P450SPα 与 P450BM3 和 P450BSβ 的比较表明,通过在活性位点战略性地放置很少的残基,这些相关金属酶的功能已经进化。和底物氧化。如此形成的Cpd I随后在脂肪酸的α-位以S-对映选择性羟基化脂肪酸。这些选择性模式由活性位点控制:底物与 Arg241 的结合决定了 α-区域选择性,而 Pro242 残基锁定前手性 α-CH2,从而导致 pro-S CH 键的羟基化。我们对突变体 Pro242Ala 的研究揭示了酶活性位点的潜在修饰,以改变反应选择性。P450SPα 与 P450BM3 和 P450BSβ 的比较表明,通过在活性位点战略性地放置很少的残基,这些相关金属酶的功能已经进化。这些选择性模式由活性位点控制:底物与 Arg241 的结合决定了 α-区域选择性,而 Pro242 残基锁定前手性 α-CH2,从而导致 pro-S CH 键的羟基化。我们对突变体 Pro242Ala 的研究揭示了酶活性位点的潜在修饰,以改变反应选择性。P450SPα 与 P450BM3 和 P450BSβ 的比较表明,通过在活性位点战略性地放置很少的残基,这些相关金属酶的功能已经进化。这些选择性模式由活性位点控制:底物与 Arg241 的结合决定了 α-区域选择性,而 Pro242 残基锁定前手性 α-CH2,从而导致 pro-S CH 键的羟基化。我们对突变体 Pro242Ala 的研究揭示了酶活性位点的潜在修饰,以改变反应选择性。P450SPα 与 P450BM3 和 P450BSβ 的比较表明,通过在活性位点战略性地放置很少的残基,这些相关金属酶的功能已经进化。s 活性位点以改变反应选择性。P450SPα 与 P450BM3 和 P450BSβ 的比较表明,通过在活性位点战略性地放置很少的残基,这些相关金属酶的功能已经进化。s 活性位点以改变反应选择性。P450SPα 与 P450BM3 和 P450BSβ 的比较表明,通过在活性位点战略性地放置很少的残基,这些相关金属酶的功能已经进化。
更新日期:2016-04-22
中文翻译:

P450-蛋白质功能的出现:对依赖 H2O2 的细胞色素 P450SPα 中反应性物质的组合量子力学/分子力学和分子动力学研究及其脂肪酸的区域和对映选择性羟基化
这项工作使用组合的量子力学/分子力学和分子动力学模拟来研究 P450SPα 类酶对脂肪酸的 H2O2 依赖性羟基化的机制和选择性。发现 H2O2 作为替代氧化剂用于生成主要氧化剂化合物 I (Cpd I),其机制涉及均裂 OO 键裂解,然后从 Fe-OH 部分提取 H。我们的结果排除了 H2O2 在到达 Cpd I 的过程中的底物辅助异裂裂解。 然而,我们表明,底物结合稳定了所得的 Fe-H2O2 复合物,这对于均溶途径中 Cpd I 的形成至关重要。氢键网络锁定了由 OO 均裂形成的 HO· 自由基,从而引导它从 Fe-OH 中专门提取氢原子,从而形成 Cpd I,同时防止与卟啉配体和底物氧化的自氧化反应。如此形成的Cpd I随后在脂肪酸的α-位以S-对映选择性羟基化脂肪酸。这些选择性模式由活性位点控制:底物与 Arg241 的结合决定了 α-区域选择性,而 Pro242 残基锁定前手性 α-CH2,从而导致 pro-S CH 键的羟基化。我们对突变体 Pro242Ala 的研究揭示了酶活性位点的潜在修饰,以改变反应选择性。P450SPα 与 P450BM3 和 P450BSβ 的比较表明,通过在活性位点战略性地放置很少的残基,这些相关金属酶的功能已经进化。和底物氧化。如此形成的Cpd I随后在脂肪酸的α-位以S-对映选择性羟基化脂肪酸。这些选择性模式由活性位点控制:底物与 Arg241 的结合决定了 α-区域选择性,而 Pro242 残基锁定前手性 α-CH2,从而导致 pro-S CH 键的羟基化。我们对突变体 Pro242Ala 的研究揭示了酶活性位点的潜在修饰,以改变反应选择性。P450SPα 与 P450BM3 和 P450BSβ 的比较表明,通过在活性位点战略性地放置很少的残基,这些相关金属酶的功能已经进化。和底物氧化。如此形成的Cpd I随后在脂肪酸的α-位以S-对映选择性羟基化脂肪酸。这些选择性模式由活性位点控制:底物与 Arg241 的结合决定了 α-区域选择性,而 Pro242 残基锁定前手性 α-CH2,从而导致 pro-S CH 键的羟基化。我们对突变体 Pro242Ala 的研究揭示了酶活性位点的潜在修饰,以改变反应选择性。P450SPα 与 P450BM3 和 P450BSβ 的比较表明,通过在活性位点战略性地放置很少的残基,这些相关金属酶的功能已经进化。这些选择性模式由活性位点控制:底物与 Arg241 的结合决定了 α-区域选择性,而 Pro242 残基锁定前手性 α-CH2,从而导致 pro-S CH 键的羟基化。我们对突变体 Pro242Ala 的研究揭示了酶活性位点的潜在修饰,以改变反应选择性。P450SPα 与 P450BM3 和 P450BSβ 的比较表明,通过在活性位点战略性地放置很少的残基,这些相关金属酶的功能已经进化。这些选择性模式由活性位点控制:底物与 Arg241 的结合决定了 α-区域选择性,而 Pro242 残基锁定前手性 α-CH2,从而导致 pro-S CH 键的羟基化。我们对突变体 Pro242Ala 的研究揭示了酶活性位点的潜在修饰,以改变反应选择性。P450SPα 与 P450BM3 和 P450BSβ 的比较表明,通过在活性位点战略性地放置很少的残基,这些相关金属酶的功能已经进化。s 活性位点以改变反应选择性。P450SPα 与 P450BM3 和 P450BSβ 的比较表明,通过在活性位点战略性地放置很少的残基,这些相关金属酶的功能已经进化。s 活性位点以改变反应选择性。P450SPα 与 P450BM3 和 P450BSβ 的比较表明,通过在活性位点战略性地放置很少的残基,这些相关金属酶的功能已经进化。































 京公网安备 11010802027423号
京公网安备 11010802027423号