Science:抗艾滋“明日之星”Bryostatin 1的克级规模全合成
Bryostatin 1作为第I类HIV潜伏期逆转剂在彻底根治艾滋病的临床研究中具有显著的效果,该化合物在癌症免疫疗法以及阿尔茨海默氏病的临床治疗研究中也起到了重要的作用。这种药物的作用靶标蛋白激酶C(PKC)同样与多种神经和心血管疾病的临床研究息息相关。然而作为一种海洋类天然产物,Bryostatin 1的含量稀缺成为制约其临床医学研究的关键因素,更为其进一步修饰从而筛选效力更强的衍生物增加了难度。
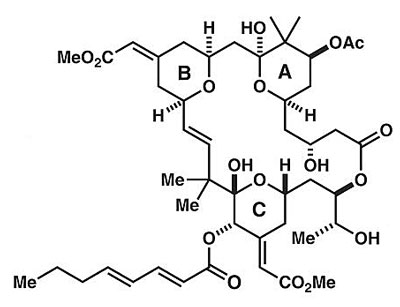
Bryostatin 1结构。图片来源:Science
自1968年Bryostatin 1首次分离后,人们发展了几种用于制备Bryostatin 1的方法,然而都存在一定的局限性。美国国立癌症研究所(NCI)起初从14吨海洋生物Bugula neritina 中以0.00014%的分离收率人工分离得到18 g Bryostatin 1,随后以超临界CO2萃取技术改进了分离流程,但受限于其本身的含量极低,很难通过该途径获取大量的目标天然产物。人们还设想通过人工养殖海洋生物Bugula neritina 的方式获取更多的Bryostatin 1,但养殖过程中高昂的成本限制了其进一步落实。与此同时,通过基因工程的方式让细菌生物合成Bryostatin 1的尝试,也因为难度较大仍旧停留在早期研究阶段。作为第三种策略,化学合成Bryostatin家族的化合物已取得了逐步的发展,步骤从最初的90步缩减到36步。然而至今Bryostatin 1唯一一例报道的全合成路线也需要57步,仍旧十分繁琐。
最近,美国斯坦福大学的Paul A. Wender教授(点击查看介绍)报道了一种高效的方法合成天然产物Bryostatin 1,全合成路线缩短至29步,其中最长线性步骤(longest linear sequence, LLS)为19步,总产率高达4.8%(平均每步的产率大于80%)。除了考虑到最后一步反应的安全因素,其余所有步骤都可以实现克级规模的制备,最终得到超过2 g的Bryostatin 1。这一成果有望推动了该药物的进一步研究与应用,相关工作发表在近期的Science 杂志上。

Paul A. Wender教授。图片来源:Stanford University
作者首先对Bryostatin 1进行逆合成分析。该天然产物具有大环内酯结构,环内嵌入三组氢化吡喃环(A、B、C环)。与此同时,该分子具有11个手性中心以及一系列复杂的官能团如烯基、醇羟基、醚基、酯基以及半缩酮结构等。受以往工作的启发,作者考虑首先分别合成复杂程度较低的A环和C环,随后通过Yamaguchi大环内酯化和Prins环化构建B环,再经由四步反应构建最终产物Bryostatin 1(图1)。
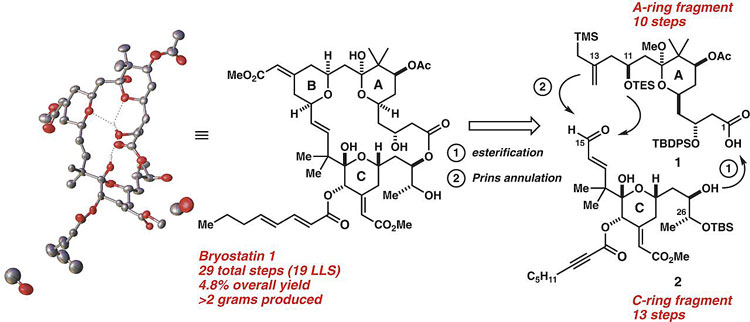
图1. Bryostatin 1的单晶结构及逆合成分析。图片来源:Science
随后,作者按如下步骤完成了该分子的全合成。首先,作者合成C环亚单元,从二氢吡喃3出发,经水解、原位异戊烯化得到二醇化合物4。随后Swern氧化、Nokami巴豆基化以很好的化学和立体选择性得到醇7。7原位缩合、环氧化得到吡喃环9。吡喃环9不稳定,迅速氧化可以得到酮10。酮10的合成是第一个需要柱层析分离的中间体。尽管所有中间体均可以纯化得到分离收率并加以表征,但为了节省时间、降低成本,此前所有步骤均无需纯化便进行下一步合成。10与化合物11发生羟醛缩合得到反式构型的中间体12,12的C20位酮羰基选择性还原、酯化得到辛炔酸甲酯13。13发生Sharpless选择性双羟基化、异丙叉基保护得到中间体14,随后C16-C17位的烯基臭氧化得到15。15接受烯基锌试剂16的亲核进攻并水解得到醛中间体18,18进一步消除缩酮保护基、C26位的羟基选择性硅醚化得到C环亚单元2。LLS为13步,总产率为16%。
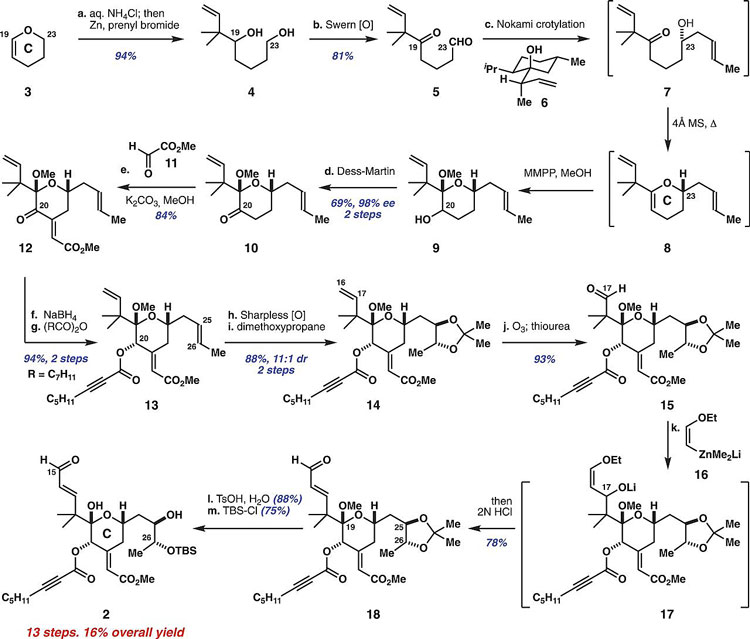
图2. C环亚单元的合成。图片来源:Science
随后作者从丙酸酯19和乙酸叔丁酯出发,经Claisen酯缩合得到β-酯20,然后在Noyori's催化剂的作用下选择性还原氢化、酯交换、C3位羟基保护基修饰、缩醛水解得到中间体21。21经底物控制与β-二酮22发生羟醛缩合得到羟基酮中间体23。23经C7位选择性还原、缩酮环化得到中间体24。24经C7位羟基乙酰化、C11位缩醛水解得到中间体25。25通过Leighton手性二胺催化剂控制发生选择性烯丙基化得到中间体28。C11位的羟基进行硅保护基修饰、C1位的酯水解得到A环亚单元1。
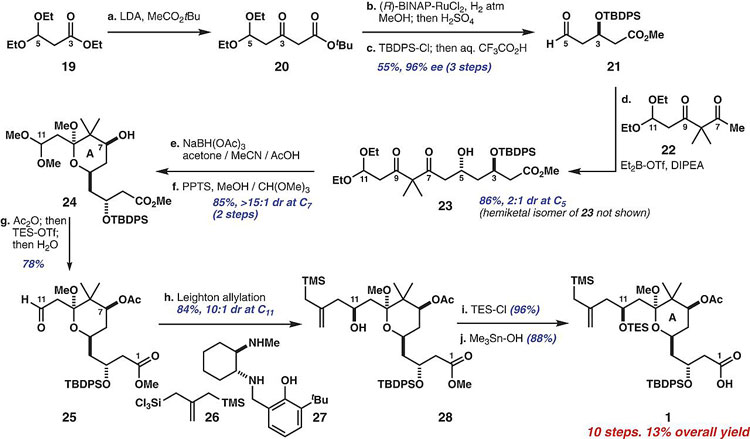
图3. A环亚单元的合成。图片来源:Science
A环和C环通过Yamaguchi大环内酯化偶联,并在对甲苯磺酸吡啶盐(PPTS)的作用下环化形成B环亚单元,得到大环内酯29,随后29发生C13位选择性臭氧化得到30。随后进行炔酸酯的异构化得到共轭二烯结构31,C13位酮羰基发生Horner- Wadsworth-Emmons烯基化得到Z 型选择性的烯烃33,33在氟化氢吡啶的作用下消除硅基保护基得到最终产物Bryostatin 1。值得一提的是,化合物29和(E )-33也可以经氟化氢吡啶作用得到Bryostatin 1的衍生物34和35。与Bryostatin 1可以高亲和性地结合PKC所有亚型不同,其衍生物34和35表现出了可贵的亚型选择性,分别对PKC-βI和PKC-δ表现出很好的亲和性。由于不同的PKC亚型与不同的疾病相关,因此类似物34和35这种具有亚型选择性的化合物就有可能用于开发效果更好副作用更少的药物,具有非常重要的研究价值。
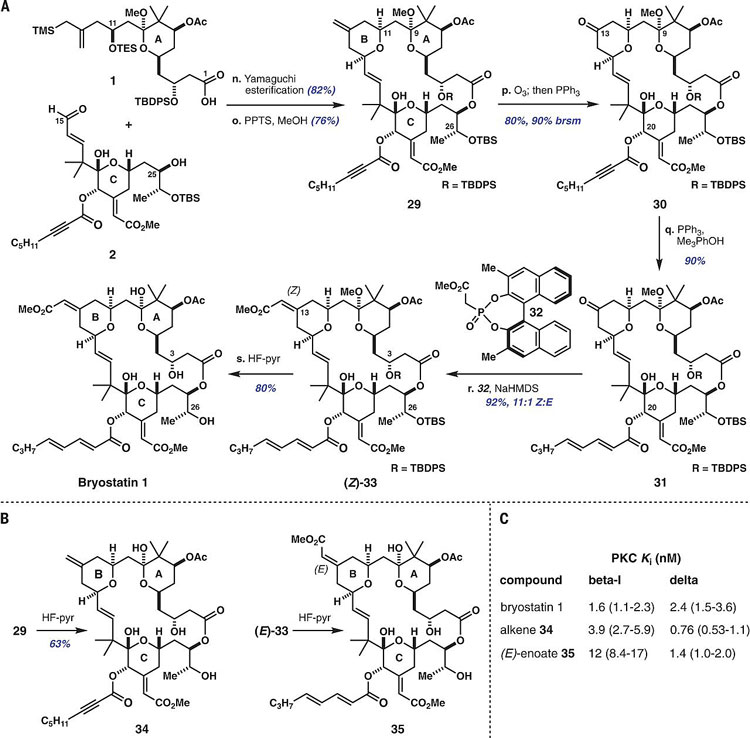
图4. Bryostatin 1的全合成及衍生化得到其他类似物。图片来源:Science
——总结——
按照目前设置的临床剂量,1 g的Bryostatin 1 可以用于治疗大约1000个癌症患者或者2000个阿尔茨海默氏症患者。Paul A. Wender教授在该研究中通过29步合成了2 g以上的Bryostatin 1,并且成功地发现其类似物34与35具有很好的生理活性和靶标蛋白亚型选择性。可以预测,该工作将大大推进Bryostatin 1相关的药物发现和临床应用等研究。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Scalable synthesis of Bryostatin 1 and analogs, adjuvant leads against latent HIV
Science, 2017, 358, 218, DOI: 10.1126/science.aan7969
导师介绍
Paul A. Wender
http://www.x-mol.com/university/faculty/435
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号